
科目:高中化学 来源:不详 题型:填空题
 NO(g)+6H2O(g) △H=-bkJ/mol
NO(g)+6H2O(g) △H=-bkJ/mol 则N2(g)+3H2(g) 2NH3(g)的△H= ;
则N2(g)+3H2(g) 2NH3(g)的△H= ;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在负极上发生氧化反应 |
| B.化学性质较活泼的金属为负极 |
| C.在外电路上电子由负极流向正极 |
| D.是由电能转化为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石墨I附近发生的反应为NO2+NO3--e-═N2O5 |
| B.石墨Ⅱ附近反生的反应为O2-4e-═2O2- |
| C.该电池放电时NO3-从右侧向左侧迁移 |
| D.相同条件下,放电过程中消耗的NO2和O2的体积比为4:1 |
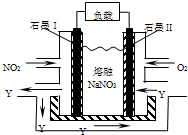
查看答案和解析>>
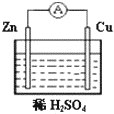
科目:高中化学 来源:不详 题型:单选题
| A.铜是负极,铜片上有气泡产生 |
| B.电流从锌片经导线流向铜片 |
| C.铜片质量逐渐减少 |
| D.氢离子在铜片表面被还原 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工作时Zn为负极,发生还原反应 |
| B.工作时电流由碳极经外电路流向Zn极 |
| C.输出电流时碳棒上发生还原反应 |
| D.长时间使用后内装糊状物可能流出,腐蚀用电器 |
查看答案和解析>>
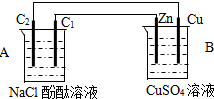
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.如图装置的电流方向是从C1到C2 |
| B.C1是负极,发生的反应是2I-═I2+2e- |
| C.K+离子向C1电极流动 |
| D.装置发生的总反应是Hg2++2I-═HgI2↓ |
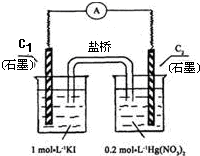
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com