
����Ŀ��Ī����[(NH4)2Fe(SO4)2��6H2O](dz��ɫ)��������ѧ�Լ���ҽҩ�Լ�����ұ�𡢵�Ƶȡ�ij������ͨ��ʵ����̽��Ī���ξ������ʱ�ķֽ����ش��������⣺
��1����ͬѧ������룻�ֽ���������N2��Fe2O3��SO3��H2O�������ʡ����Ƿ�ͬ�Ⲣ˵������___________________________��
��2����ͬѧ�������ͼװ�ã�
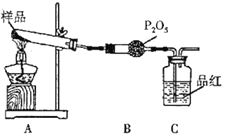
������Aװ���еĹ����Ϊ����ɫ�����������к���_________________��Cװ���к�ɫ��ȥ��˵����������к���_______________________��
��Ϊ��֤A�в������Ƿ���FeO����Ҫѡ���Լ���__________��
A.KSCN��Һ B.Ũ���� C.KMnO4��Һ D.ϡ����
��3����ͬѧ��������ͬѧ��װ��֤���ֽ�����к��а�����ֻ�����B��C �е��Լ����ɣ����������Լ�BΪ______________��CΪ________________��
��4����ͬѧ��ΪĪ���ξ���ֽ����������к���SO3(g)��SO2(g)��N2��Ϊ�˽�����֤����ͬѧѡ����ͬѧ��Aװ�ú���ͼװ����װ�����ʵ�顣
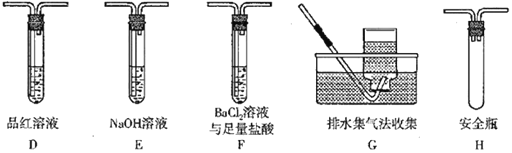
�ٶ�ͬѧ��ʵ���У�װ���������ӵĺ���˳��ΪA��________��
��װ��F�У����������������____________________��
���𰸡� �������ֲ��������ֻ�л��ϼ۵���û�л��ϼ۽� Fe2O3 SO2 CD ��ʯ�� ��ɫʯ����Һ HFDEG ������Һ����ȣ�����SO2���ܽ�
����������1����ͬѧ������룻�ֽ���������N2��Fe2O3��SO3��H2O�������ʣ������ֲ��������ֻ�л��ϼ۵���û�л��ϼ۽���������������ԭ��Ӧ���ɣ���ȷ�𰸣��������ֲ��������ֻ�л��ϼ۵���û�л��ϼ۽���
��2��������������Ϊ����ɫ�����Թ�������к���Fe2O3��Ʒ����ɫ��˵�������˶����������壻��ȷ�𰸣�Fe2O3 ��SO2 ��
��A�в������ȼ���ϡ���ᣬ����FeO�������������������ټ���KMnO4��Һ���������ӱ�������������ر���ԭ����Һ��ɫ��֤�������������ӣ�ԭ�����к���FeO����ȷѡ��CD ��
��3���Լ�B�м����ʯ�ң����ն����������壬Ȼ�����ð�����ˮ��Һ�Լ��ԣ�ʹ��ɫʯ����Һ������֤���а������ɣ���ȷ�𰸣���ʯ�ң� ��ɫʯ����Һ��
��4���ٿ�֪Aװ�ú����ֱ�����Ӵ�����Һ��װ�ÿ��ܻᷢ�����������Aװ�ú�Ӧ���Ӱ�ȫƿH����![]() ������ˮ����֪Ӧ����
������ˮ����֪Ӧ����![]() ����
����![]() �����������ͨ��Fװ�ã�����
�����������ͨ��Fװ�ã�����![]() Ӧѡ��Ʒ����Һ�� F���D����
Ӧѡ��Ʒ����Һ�� F���D����![]() ���ж����壬D���E�����ն����������壬�������G�������Ƿ���
���ж����壬D���E�����ն����������壬�������G�������Ƿ���![]() ��������ȷ����HFDEG��
��������ȷ����HFDEG��
��װ��F�У����������������������Һ����ȣ�����SO2���ܽ⣻��ȷ�𰸣�������Һ����ȣ�����SO2���ܽ⡣


 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д� ��˼άС�ھ�100����ҵ��ϵ�д�
��˼άС�ھ�100����ҵ��ϵ�д� ��ʦָ��һ��ͨϵ�д�
��ʦָ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ksp(AgCl)=1.8��10-10 �� Ksp(AgI)=1.5��10-16 �� Ksp(Ag2CrO4)=2.0��10-12 �� �����������εı�����Һ�У�Ag+Ũ�ȴ�С˳����ȷ���ǣ� ��
A.AgCl >AgI> Ag2CrO4
B.AgCl> Ag2CrO4 >AgI
C.Ag2CrO4>AgCl >AgI
D.Ag2CrO4>AgI >AgCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�ݻ�һ�����ܱ������У������п��淴ӦxA��g��+B��g��2C��g������Ӧ���ߣ�T��ʾ�¶ȣ�P��ʾѹǿ��C%��ʾC�������������ͼ��ʾ�����ж϶�ͼ��˵����һ����ȷ���ǣ�������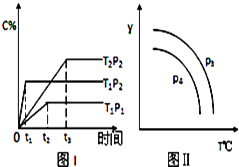
A.�÷�Ӧ�����ȷ�Ӧ
B.x=2
C.P3��P4 �� y��ɱ�ʾ����������Է�������
D.P3��P4 �� y��ɱ�ʾC������ƽ������еİٷֺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ������ü����ṩ������ȼ�ϵ������ʿ�Ƽ������߿����ɹ���ȼ�ϵ�ذ����������֣���(HYFORM)��ʹ����(Ru)�������Ӽ����в�����������(PEMFC)����NaOHΪ����ʵ�����ȼ�ϵ�ء�װ�õ�ԭ��ʾ��ͼ��ͼ�������й�˵��������ǣ�������

A. ��ȼ�ϵ��ʹ�õļ�����������״��������
B. Y�ҵĵ缫��Ӧʽ��O2+4H++4e-=2H2O
C. X��Ϊ�����ң�Y��Ϊ������
D. ��������1mol���ᣬ����ת��2mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�Ԫ�ؼ��仯����ı�ʾ��ȷ����
A. �����ĵ���ʽ��![]()
B. CH4���ӵ����ģ�ͣ�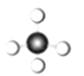
C. Mg2+�ṹʾ��ͼ��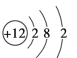
D. ������Ϊ92��������Ϊ146��Uԭ�ӣ�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڷ�ӦKClO3+6HCl=KCl+3Cl2��+2H2O��˵������ȷ���ǣ� ��
A.KClO3��������
B.H2O�Ȳ�����������Ҳ���ǻ�ԭ����
C.HCl�ǻ�ԭ��
D.KCl���ǻ�ԭ����Ҳ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��������{���ӻ��������
A. ˮ���к��е�ά����C B. ʯ���к��е�C16H34
C. �۲��к��е���ά�� D. ֲ�����к��е���֬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ĺ̶��Թ�ũҵ��������������ش����塣
��.�ϳɰ�������Ҫ���˹��̵���N2(g)+3H2(g)![]() 2NH3(g)��
2NH3(g)��
��1�����й��ڸ÷�Ӧ��˵���У���ȷ���� ��
A����H��0,��S��0 B����H��0����S��0
C����H��0,��S��0 D����H��0,��S��0
��2�� �����¶��£����ݻ�Ϊ1L���ܱ������У�����ImolN2��3molH2����Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%����������·�Ӧ��ƽ�ⳣ��K= (�˴���Ҫ��д��λ)����������������䣬���������м���lmolN2��3molH2��Ӧ�ﵽƽ��ʱ��������ת���ʽ� (���������С�����䡱)
��3����״���£�����22.4mL�İ���ͨ��100mLpHΪ2��������.����Һ�и�����Ũ�ȵ�˳���ɴ�СΪ ��
��4��������ͨ��ʢ��CaSO4����Һ�ij������У���ͨ��������CO2���壬��ַ�Ӧ����������ҺΪ(NH4)2SO4��Һ���ù��̵Ļ�ѧ����ʽΪ ��
II.�����о��IJ������룬��ѧ�ҷ�����Խ��Խ���йص��Ĺ̶�������
��5��20����ĩ����ѧ�Ҳ��ø����ӵ����Ե�SCY�մ�(�ܴ���H+)Ϊ���ʣ�������������������ϵĽ����ٶྦྷ��Ĥ���缫��ʵ�ֳ�ѹ��570�����µĵ�ⷨ�ϳɰ�������˷�Ӧ���ת���ʣ���ʵ���ͼ���£������ĵ缫��ӦʽΪ ��

��6�����꣬���п�ѧ������ڳ��¡���ѹ�������������ºϳɰ�������˼·����Ӧԭ��Ϊ��
2N2(g)+6H2O(I) ![]() 4NH3(g)+3O2(g)�����䷴Ӧ����H= ��(��֪��N2(g)+3H2(g)
4NH3(g)+3O2(g)�����䷴Ӧ����H= ��(��֪��N2(g)+3H2(g) ![]() 2NH3(g) ��H=-92.4kJ��mol-1��2H2(g)+O2(g)
2NH3(g) ��H=-92.4kJ��mol-1��2H2(g)+O2(g) ![]() 2H2O(I) ��H=-571.6kJ��mol-1)
2H2O(I) ��H=-571.6kJ��mol-1)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com