
| A. | 17.92L | B. | 22.4L | C. | 8.96L | D. | 11.2L |
分析 至铜完全溶解后,再向溶液中加人铜时,发现铜不再溶解,说明铜与硝酸恰好完全反应,生成气体为NO和二氧化氮的混合气体,根据n=$\frac{m}{M}$计算出铜的物质的量,从而可知硝酸铜中硝酸根离子的物质的量,然后根据N原子守恒计算出混合气体的物质的量,最后根据V=nVm计算出混合气体的体积.
解答 解:38.4gCu的物质的量为:$\frac{38.4g}{64g/mol}$=0.6mol,0.6mol铜完全反应生成0.6mol硝酸铜,含有硝酸根离子的物质的量为:0.6mol×2=1.2mol,
将38.4gCu与含有2mol HNO3的浓硝酸反应至铜完全溶解后,再向溶液中加人铜时,发现铜不再溶解,说明铜与硝酸恰好完全反应,生成气体为NO和二氧化氮的混合气体,根据N原子守恒可知生成混合气体的物质的量为:2mol01.2mol=0.8mol,
标准状况下0.8mol气体的体积为:22.4L/mol×0.8mol=17.92L,
故选A.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol任何物质都含有6.02×1023个原子 | |
| B. | 标准状况下,22.4L NH3的物质的量为1mol | |
| C. | 硫酸的摩尔质量是98 g | |
| D. | 常温常压下,1 mol氧气的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解FeS固体:FeS+2H+═Fe2++H2S↑ | |
| B. | 氯气通入澄清石灰水中:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO${\;}_{3}^{2-}$+2HClO | |
| D. | 等体积、等物质的量浓度AlCl3与NaOH溶液混合:Al3++4OH-═AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
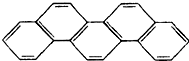 有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )
有一种有机物,因其酷似奥林匹克五环旗(如图),科学家称其为“奥林匹克烃”,下列有关“奥林匹克烃”的说法正确的是( )| A. | 该有机物属芳香烃 | |
| B. | 该物质属氨基酸 | |
| C. | 该物质分子中只含非极性键 | |
| D. | 该物质完全燃烧产生水的物质的量小于CO2的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL1mol/L的Na3PO4溶液中含有离子数多于0.4NA | |
| B. | 1molAlCl3跟水反应完全转化成氢氧化铝胶体后,生成胶体粒子的数目为1NA | |
| C. | 12g石墨晶体中含有碳碳键数目为2×6.02×1023 | |
| D. | 标准状况下,22.4LCHCl3中含有氯原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中含有碳碳三键的不饱和链烃 | |
| B. | 易发生加成反应 | |
| C. | 既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 | |
| D. | 分子里所有的碳原子都处于同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$的值及SO2转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热大于 110.5 kJ/mol | |
| B. | ①的反应热为 221 kJ/mol | |
| C. | 稀硫酸与稀 NaOH溶液反应的中和热为-57.3kJ/mol | |
| D. | 稀醋酸与稀 NaOH溶液反应生成 1mol水,放出 57.3kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com