



 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
| ||
| ||
| A、制取等量的硝酸铜,需硝酸的量②最少 |
| B、制取等量的硝酸铜,②产生的有毒气体比①少 |
| C、三种方案中,第③方案最经济环保 |
| D、三种方案的反应都可以在铁质容器中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )
将气体甲通入液体乙中得一混合液,取一定质量的该混合液进行完全燃烧实验,生成CO2、H2O的质量与甲气体在混合液中质量分数关系如图所示,甲、乙组合正确的是( )| A、乙烯 环己烷 |
| B、甲烷 苯 |
| C、乙炔 苯 |
| D、乙烷 乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:2 |
| C、2:3 | D、3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外成对电子数是未成对电子数的2倍,B原子的外围电子排布为nsnnpn+1,C元素是地壳中含量最高的元素,化合物D2E的晶体为离子晶体,E原子核外M层中只有两对成对电子;F原子核外最外层电子数与D相同,其余各层电子均充满.请根据以上信息,回答下列问题:(用所对应的元素符号或化学式表示)
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大.其中A原子核外成对电子数是未成对电子数的2倍,B原子的外围电子排布为nsnnpn+1,C元素是地壳中含量最高的元素,化合物D2E的晶体为离子晶体,E原子核外M层中只有两对成对电子;F原子核外最外层电子数与D相同,其余各层电子均充满.请根据以上信息,回答下列问题:(用所对应的元素符号或化学式表示)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、下列是A、B、C、D、E五种短周期元素的某些性质
Ⅰ、下列是A、B、C、D、E五种短周期元素的某些性质| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| X | Y | Z | |
| 第一电离能(kJ/mol) | 520.2 | 495.8 | 418.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
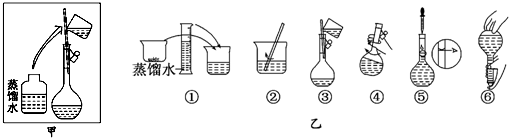
| a | b | c | d | e | |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
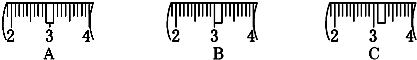
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com