
【题目】用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) AH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )
CH3OH(g) AH<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示,下列说法正确的是( )

A. 温度:T1>T2>T3
B. 正反应速率:v(a)>v(c), v(b)>v(d)
C. 平衡常数:K(a)>K(c),K(b)=K(d)
D. 平均摩尔质量:M(a)<M(c),M(b)<M(d)
科目:高中化学 来源: 题型:
【题目】已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
A.CO2的平衡转化率α=2.5%
B.0~4 min内用H2S表示该反应的速率为0.001 mol·L1·min1
C.上述条件下反应达到平衡时放出的热量为0.01Q kJ
D.其他条件不变,若该反应在温度为T2条件下进行,达到平衡所需时间小于4 min,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿比朵尔是一种抗病毒药物,其分子结构如图,关于阿比朵尔说法不正确的是
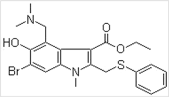
A.阿比朵尔分子式为 C22H24BrN2O3S
B.阿比朵尔能与碱或酸溶液反应生成盐
C.阿比朵尔一定条件下能发生取代、加成、氧化、还原反应
D.一定条件下,1 mol 阿比朵尔与足量 NaOH 溶液反应,最多可消耗 4 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设[aX+bY]为 a 个 X 微粒和 b 个 Y 微粒组成的一个微粒集合体,N(z)为微粒 z 的数量,NA 为阿伏加德罗常数的值。下列说法一定不正确的是
A.C(石墨)+O2(g) = CO2(g) ΔH=-390 kJ·mol1,则每 1 mol [![]() C(石墨)+
C(石墨)+![]() O2(g)]完全燃烧放热 130 kJ
O2(g)]完全燃烧放热 130 kJ
B.Cu 与 1mol/L 的硝酸溶液充分反应,若生成 22.4 L 气体,则转移电子数为 3NA
C.标准状况下 1.6g 氧气含分子数为 0.05NA,且平均每个 O2 分子的体积约为 ![]() L
L
D.1 mol Cl2 与稀 NaOH 溶液完全反应,则反应后的溶液中 N(ClO)+N(HClO)=1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究钠与二氧化碳的反应,利用如图装置进行实验。
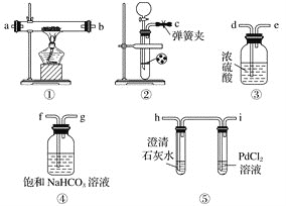
已知PdCl2能被一氧化碳还原得到黑色的Pd。请回答下列问题:
(1)请将上图各装置连接完整:c接f,______接______,______接______,______接______。
(2)若用稀盐酸与碳酸钙反应制备二氧化碳,在加稀盐酸时,发现碳酸钙与稀盐酸不能接触,而稀盐酸又不够了,为使反应能顺利进行,可向长颈漏斗中加入的试剂是______(填字母)。
A.硝酸钠溶液 B.四氯化碳 C.苯 D.稀硝酸
(3)检查装置气密性并装好药品后,点燃酒精灯之前应进行的操作是打开弹簧夹,让二氧化碳充满整个装置,当观察到________________时,再点燃酒精灯。此步操作的目的是________________________________。
(4)反应过程中二氧化碳足量,假如反应过程中有下列两种情况,分别写出两种情况下钠与二氧化碳反应的化学方程式。
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体: ___________________________。
Ⅱ.装置①中钠的质量为0.46 g,充分反应后,将装置①中的固体加入到足量稀盐酸中产生224 mL(标准状况)二氧化碳气体,且溶液中还有固体残留:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的值)( )
A. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
B. 标准状况下,18 g H2O所占的体积约是22.4 L
C. 32 g O2在标准状况下所占的体积约为22.4 L
D. 2.4g金属镁变为镁离子时失去的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫酸法钛白粉生产中排放的含锰废水(主要金属离子为Mn2+、Fe2+、Al3+,还含有少量Ca2+、Mg2+、Cu2+和Ni2+等离子)为原料,生产MnCO3的工艺流程如下:
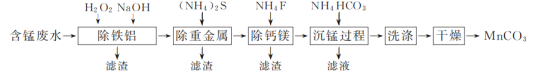
已知:25 ℃时,Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11。
(1)流程中含锰废水经过前三步预处理,得到主要含有Mn2+的母液。
①除铁铝时,在搅拌条件下先加入H2O2溶液,再加入NaOH溶液调节pH。加入H2O2溶液时发生反应的离子方程式为__________________________________________。
②除钙镁步骤中,当Ca2+、Mg2+沉淀完全时,溶液中![]() =________。
=________。
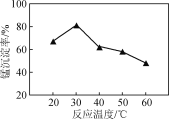
(2) 沉锰过程在pH为7.0条件下充分进行,反应温度对锰沉淀率的影响关系如图所示。
①沉锰过程发生反应的离子方程式为____________。该过程中加入适当过量的NH4HCO3的原因是________。
②当温度超过30 ℃,沉锰反应的锰沉淀率随温度升高而下降的原因是______________________________。
(3) 沉锰后过滤得到MnCO3粗产品,依次用去离子水和无水乙醇各洗涤2~3次,再低温干燥,得到纯净的MnCO3。用无水乙醇洗涤的目的是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(某混合物甲中含有明矾[KAl(SO4)2·12H2O]、Al2O3和Fe2O3。在一定条件下由甲可实现如图所示的物质之间的转化:

请回答下列问题:
(1)写出A、B的化学式:A___,B___。
(2)试剂a最好选用下列试剂中的(______)
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
写出相应的离子方程式___。
(3)写出反应②(生成溶液C和沉淀)的离子方程式___。
(4)固体D可以作为复合性的化学肥料,D中所含物质的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LDFCB是锂离子电池的一种电解质,该电解质阴离子由同周期元素W、X、Y、Z构成(如下图),Y的最外层电子数等于X的核外电子总数,四种元素最外层电子数之和为20。下列说法正确的是( )
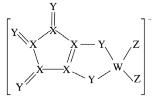
A.四种元素的单质中,Z的沸点最高
B.原子半径∶W>X>Y>Z
C.W、Z形成的分子中各原子均满足8电子稳定结构
D.Y分别与另外三种元素形成的二元化合物中,Y的价态相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com