
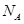 表示阿伏加德罗常数,则立方氮化硼晶胞体积为 cm3。
表示阿伏加德罗常数,则立方氮化硼晶胞体积为 cm3。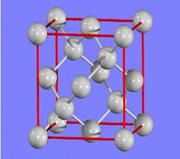
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:不详 题型:单选题
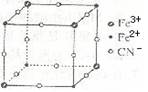
| A.该晶体的化学式为MFe2(CN)6 |
| B.该晶体属于离子晶体,M呈+1价 |
| C.该晶体属于离子晶体,M呈+2价 |
| D.晶体中与每个Fe3+距离最近且等距离的CN-为3个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
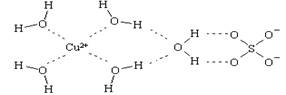
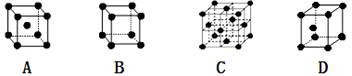
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
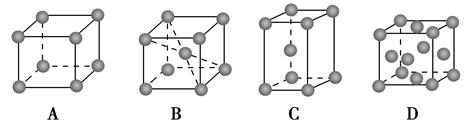

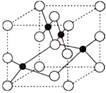
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
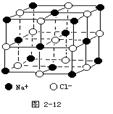
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NaCl晶体中每个Na+周围同时吸引6个Cl- |
| B.干冰晶体中每个CO2分子周围与它距离最近且等距的CO2分子有12个 |
| C.金刚石晶体中最小的碳环为六元环,为平面正六边形 |
| D.石墨晶体中每个碳原子与其他3个碳原子间形成共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com