
| A. | 玻璃棒 | B. | 胶头滴管 | C. | 烧杯 | D. | 漏斗 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 活泼金属在空气中易与氧气反应,都能在其表面形成一层致密的氧化膜 | |
| B. | 钠比铜的活泼性强,所以钠投入到CuSO4溶液中可置换出单质铜 | |
| C. | 等质量的铝粉分别与足量的盐酸或NaOH溶液完全反应时,产生的气体质量相等 | |
| D. | 用铁制或铝制容器来盛装浓硝酸,是因为Fe或Al不能与冷的浓硝酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 样品中只含有一种杂质NaHCO3 | B. | 样品中含有KCl,不含有NaHCO3 | ||
| C. | 样品中含有Ba(NO3)2和NaHCO3 | D. | 样品中含有KCl和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
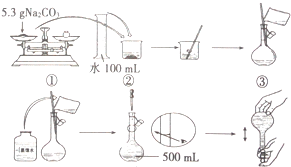 某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol•L-1的Na2CO3溶液.溶液的配制过程如图所示:
某兴趣小组为探究Na2CO3溶液的性质,需要480mL0.2mol•L-1的Na2CO3溶液.溶液的配制过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2 $\stackrel{光}{→}$CH3Cl+HCl | |
| B. | 2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | CH3CH2OH+CH3C00H$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | CH2═CH2+Br2→BrCH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子由铁棒通过导线流向铜棒 | B. | 正极反应为Fe-2e-═Fe2+ | ||
| C. | 铜棒逐渐溶解 | D. | 该装置能将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
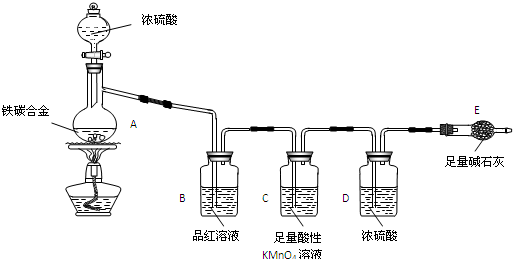
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com