


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用SO2漂白食品 |
| B.自来水中通入少量Cl2进行消毒杀菌 |
| C.用小苏打(NaHCO3)发酵面团制作馒头 |
| D.用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
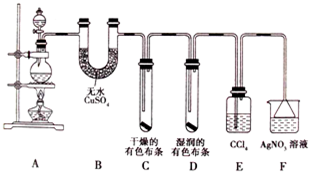
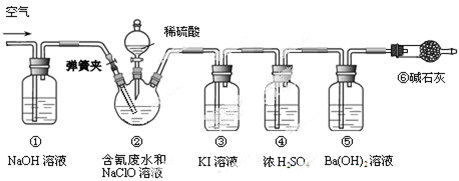
科目:高中化学 来源:不详 题型:实验题
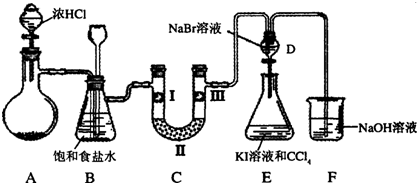
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向氯水中通入少量二氧化硫,氯水的漂白性增强 |
| B.氯水中加入NaCl固体,对溶液的pH无影响 |
| C.常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L |
| D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | NO2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.臭氧、活性炭处理水的原理相同 |
| B.氯气是一种常用的消毒剂,用氯气消毒的水也可以用于配制化学试剂 |
| C.氯气和二氧化硫都具有漂白性,等体积的两者混合会提高漂白的效率 |
| D.漂白粉长期露置在空气中会失效 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
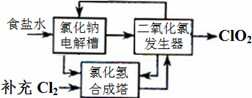
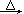 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com