
��12�֣�2013���������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
��1��CO2�Ǵ����к�����ߵ�һ���������壬���ƺ�����CO2�ǽ������ЧӦ����Ч;����Ŀǰ����CO2���ϳɶ�������ȡ���˽ϴ�Ľ�չ���仯ѧ��Ӧ�ǣ�
2CO2��g��+6H2��g�� CH3OCH3��g��+3H2O��g�� ��H��0��
CH3OCH3��g��+3H2O��g�� ��H��0��
��д���÷�Ӧ��ƽ�ⳣ������ʽ ��
���жϸ÷�Ӧ��һ�������£�����㶨���ܱ��������Ƿ�ﵽ��ѧƽ��״̬�������� ��
A���������ܶȲ���
B����λʱ��������2molCO2��ͬʱ����1mol������
C��v(CO2)�Uv(H2)=1�U3
D��������ѹǿ���ֲ���
��2������β����������Ҫԭ��Ϊ��2NO(g)+2CO (g)  2CO2 (g) +N2 (g) ���ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯���ߣ���ͼ��ʾ��
2CO2 (g) +N2 (g) ���ܱ������з����÷�Ӧʱ��c(CO2)���¶�(T)�������ı����(S)��ʱ��(t)�ı仯���ߣ���ͼ��ʾ��

�ݴ��жϣ�
�ٸ÷�Ӧ�Ħ�H 0��ѡ�����������������
�ڵ��������������һ��ʱ�����������������ѧ��Ӧ���ʡ��������ı����S1��S2������ͼ�л���c(CO2)��T2��S2�����´ﵽƽ������еı仯���ߡ�
��3����֪��CO��g���� 2H2��g�� CH3OH��g����H = -a kJ?mol-1��
CH3OH��g����H = -a kJ?mol-1��
�پ��ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
�¶ȣ��棩 | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
��ijʱ�̡�250���ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊc(CO)=0.4 mol��L��1��c(H2)=0.4 mol��L��1��c(CH3OH)=0.8 mol��L��1, ���ʱv�� v�棨���������������=������
��ij�¶��£�������̶���2L���ܱ������н�1 mol CO��2 mol H2��ϣ���ò�ͬʱ�̵ķ�Ӧǰ��ѹǿ��ϵ���£�
ʱ�䣨min�� | 5 | 10 | 15 | 20 | 25 | 30 |
ѹǿ��(P��/Pǰ) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
�ﵽƽ��ʱCO��ת����Ϊ ��
��1���� ��B��D��2�֣���ѡ1����1�֣�
��2���٣�
�ڣ�2�֣�

��3���٣���2�֣� �� 45%��2�֣�
��������
�����������1���ٸ����������ʽд���÷�Ӧ��ƽ�ⳣ������ʽ
K=c��CH3OCH3����c3��H2O��/c2��CO2��c6��H2������A����������㶨��������������䣬�ܶȲ��淴Ӧ�Ľ��ж��仯���ܶȲ��䲻����Ϊƽ���־������B����λʱ��������2molCO2��ͬʱ����1mol�����ѣ������淴Ӧ������ȣ�����ƽ���־����ȷ��C��û����ȷ�����淴Ӧ���ʣ�v(CO2)�Uv(H2)=1�U3 ������Ϊƽ���־������D���÷�ӦΪ��Ӧǰ���������ʵ������ȵķ�Ӧ��������ѹǿ�淴Ӧ�Ľ��в��ϱ仯��������ѹǿ���ֲ����Ѵ�ƽ��״̬����ȷ��ѡBD����2���� ��ͼ���֪�¶�ΪT1ʱ��Ӧ�ȴﵽƽ�⣬��Ӧ���ʿ죬���¶ȣ�T1��T2,�¶�ΪT1ʱ������̼��ƽ��Ũ��С��˵�������¶�ƽ�������ƶ�������ӦΪ���ȷ�Ӧ����H��0���ڸ��������Ϣ֪���������������һ��ʱ�����������������ѧ��Ӧ���ʣ����̴�ƽ���ʱ�䣬��ƽ�ⲻ�ƶ���������̼��ƽ��Ũ�Ȳ��䣬ͼ����𰸣�(3���ٸ����������ʽ�����ݼ���Q= c��CH3OH��/c2��H2��c��CO��=0.8/0.4��0.42=12.5���ɱ�������֪250��ʱK=2.041��Q��K����Ӧ������У���ʱv����v�棻�ڸ�������ʽ���㣬��ת����CO�����ʵ���Ϊx��
CO��g���� 2H2��g�� CH3OH��g��
CH3OH��g��
��ʼ����mol��1 2 0
ת������mol��x 2x x
ƽ������mol��1��x 2��2 x x
���ݱ�������֪��ƽ���P��/Pǰ=0.70�����ݰ����ӵ����ɣ����µ���ʱѹǿ֮�ȵ�����������ʵ���֮�ȼ�(3��2x)/3=0.70�����x=0.45��һ����̼��ת����Ϊ45%��
���㣺���黯ѧ��Ӧ���ʺͻ�ѧƽ�⡣


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ���ݵ���7У������ѧ����ĩģ��������ѧ�Ծ��������棩 ���ͣ�ʵ����
��6�֣�ij�о���ѧϰС�����о���������Ư������ʱ���ӡ�������Ư������ʵ������������ˮ��Ӧ���ɵĴ������Ư�����á��õ�������Ϊ��̽�������������õõ����Ƕ������������Ƕ���������ˮ���õIJ����С�����������ʵ�顣��ش�������⡣
��1��ʵ�������������Ʒ�ĩ��������ȡ��������������������������Һ��Ӧѡ�� ������ĸ����
A��98%Ũ���� B��70%���� C��10%ϡ����
��2��Ϊ��̽��SO2�ܷ�ʹƷ����ɫ����ͬѧѡ������ȷ��ҩƷ�����������ͼ��ʾʵ��װ�ã���ָ��ʵ��װ������еIJ�����֮����

�� ���� ��
��3����ͬѧѡ������ȷװ�ú�ʵ���п��ƶ��������Դ�Լÿ��3�����ݵ��ٶ�ͨ��Ʒ��ľƾ���Һʱ������һСʱ��Ʒ���Բ���ɫ��Ϊ�ˣ�����ΪʹƷ���ˮ��Һ��ɫ���������� ��
��4����ͬѧ��һ��ʵ�����£�ȡ������ͬŨ�ȵ�Ʒ��ˮ��Һ����֧�Թ��У��ٷֱ���������������ƹ�������������ƹ��壬��֧�Թ��е�Ʒ�춼��ɫ�����ó��Ľ��ۣ�ʹƷ����ɫ�����϶���HSO3-��SO32-������Ϊ���Ľ����Ƿ���ȷ ���������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����л�ѧ�����������ȷ����
A��ԭ�ӽṹʾ��ͼ �����Ա�ʾ12C��Ҳ���Ա�ʾ14C
�����Ա�ʾ12C��Ҳ���Ա�ʾ14C
B������ģ�� �����Ա�ʾ������̼���ӣ�Ҳ���Ա�ʾˮ����
�����Ա�ʾ������̼���ӣ�Ҳ���Ա�ʾˮ����
C������ʽ�� ���Ա�ʾ�ǻ���Ҳ���Ա�ʾ����������
���Ա�ʾ�ǻ���Ҳ���Ա�ʾ����������
D������ʽC2H4O2�����Ա�ʾ���ᣬҲ���Ա�ʾ�Ҷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�人�����������Ԫ�µ������ۻ�ѧ�Ծ��������棩 ���ͣ������
��15�֣�����������ʵ�����ɳ�����չ����Ҫ����ͼ���Ժ�H2S���ʵ���Ȼ��Ϊԭ����ȡ����������ͼ��

�ش��������⣺
��1����Ӧ�ڵĻ�ѧ����ʽΪ ��
��2����Ӧ�ܵ����ӷ���ʽΪ ��
��3�����������������ԭ�����£�
��CH4(g)��H2O(g) CO(g)��3H2(g) ��H����206.4 kJ��mol��1
CO(g)��3H2(g) ��H����206.4 kJ��mol��1
��CO(g)��H2O(g)  CO2(g)��H2(g) ��H����41.2 kJ��mol��1
CO2(g)��H2(g) ��H����41.2 kJ��mol��1
�ٶ��ڷ�Ӧ��һ���������ƽ����ϵ��H2�İٷֺ��������ܼӿ췴Ӧ���ʵĴ�ʩ�� ������ĸ���ţ���
a�������¶� b������ˮ����Ũ�� c��������� d������ѹǿ
�����÷�Ӧ��CO��һ��ת���������H2�IJ�������1.00 mol CO��H2�Ļ�����壨CO���������Ϊ20%����H2O��Ӧ���õ�1.18 mol CO��CO2��H2�Ļ�����壬��CO��ת����Ϊ ��
��������Ȼ����������������Ϊ5%���Ҽ�����ˮ������Ӧת���ɶ�����̼����������ת����Ϊ80%����ͨ����������1.00 m3 ��Ȼ�������Ͽ��Ƶ����� m3��ͬ��ͬѹ�����£���
��4��һ�������£���ͼ��ʾװ�ÿ�ʵ���л���ĵ绯ѧ���⣨���ɵ��л���Ϊ���壬���������л����
������Ŀ�����ĵ缫��ӦʽΪ ��
�ڸô���װ�õĵ���Ч��Ϊ�ǣ� �����ǣ�  ��100%������������С�����1λ��
��100%������������С�����1λ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�人�����������Ԫ�µ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��CuSO4��Һ����μ���KI��Һ���������۲쵽������ɫ����CuI����Һ��Ϊ��ɫ������Ӧ��Ļ�����в���ͨ��SO2���壬��Һ�����ɫ�����з�����ȷ����
A������ʵ�������£����ʵ������ԣ�Cu2+ > I2 > SO2
B��ͨ��SO2ʱ��SO2��I2��Ӧ��I2����ԭ��
C��ͨ��SO2����Һ�����ɫ��������SO2��Ư����
D���μ�KI��Һʱ��ת��2 mol e�� ʱ����1 mol��ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ӱ�ʡ����12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�������£����淴Ӧ��X(g) + 3Y(g) 2Z(g),��X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3 ������Ϊ�㣩����Ӧ�ﵽƽ��ʱ,X��Y��Z��Ũ�ȷֱ�Ϊ0.1mol?L-1��0.3 mol?L-1��0.08 mol?L-1.�������жϲ���ȷ����
2Z(g),��X��Y��Z����ʼŨ�ȷֱ�Ϊc1��c2��c3 ������Ϊ�㣩����Ӧ�ﵽƽ��ʱ,X��Y��Z��Ũ�ȷֱ�Ϊ0.1mol?L-1��0.3 mol?L-1��0.08 mol?L-1.�������жϲ���ȷ����
A��c1��c2== 1��3 B��ƽ��ʱ��Y��Z��������֮��Ϊ3��2
C��X��Y��ת���ʲ���� D��c1��ȡֵ��ΧΪ0< c1< 0.14 mol?L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ӱ�ʡ����12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ij��Ӧ���������仯��ͼ��ʾ������˵����ȷ����
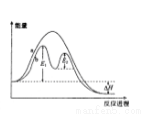
A����Ӧ����a�д�������
B���÷�ӦΪ���ȷ�Ӧ����ЧӦ���ڦ�H
C���ı�������ɸı�÷�Ӧ�Ļ��
D���д��������£���Ӧ�Ļ�ܵ���E1+E2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ����У�����������ۻ�ѧ�Ծ��������棩 ���ͣ������
(16��)����Ǧ(PbSO4)�㷺Ӧ��������Ǧ���ء���ɫ���ϵȡ����÷�Ǧ��(PbS)ֱ���Ʊ�����Ǧ��ĩ���������£�

��֪��������PbCl2(s)+2Cl��(aq) PbCl42�� (aq) ��H��0
PbCl42�� (aq) ��H��0
������Ksp(PbSO4)��1.08��10��8��Ksp(PbCl2)��1.6��10��5
������Fe3����Pb2��������������ʽ��ȫ����ʱ����Һ��pH�ֱ�Ϊ3.2��7.04
��1���������FeCl3��Һ��PbS��Ӧ����PbCl2��S�����ӷ���ʽΪ �����������һ����Ӧ��H2O2��FeCl2�����ᷴӦ����FeCl3��ʵ��FeCl3���ظ����ã������ӷ���ʽΪ �������������һ��Ŀ����Ϊ�˿���pH��0.5��1.0��ԭ���� ��
��2���û�ѧƽ���ƶ���ԭ�����Ͳ������ʹ�ñ�ˮԡ��ԭ�� ��
��3��д��PbCl2����ת��ΪPbSO4���������ӷ���ʽ ��
��4����Һ3�� ��
��5��Ǧ���صĵ��Һ��ϡ����(22%~28%)�����������缫�ϳ�����PbSO4�ֱ�ת��ΪPbO2��Pb��Ǧ���س��ʱ�����ĵ缫��ӦʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�걱���и�һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������Σ�ջ�ѧƷ��־�Ķ�Ӧ��ϵ����ȷ����

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com