
【题目】![]() 是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是( )
是硅酸盐水泥的重要成分之一,其相关性质的说法不正确的是( )
A. 可发生反应:![]()
B. 具有吸水性,需要密封保存
C. 能与![]() ,反应生成新盐
,反应生成新盐
D. 与足量盐酸作用,所得固体产物主要为![]()
【答案】D
【解析】
将Ca3SiO5改写为氧化物形式后的化学式为:3CaO·SiO2,性质也可与Na2SiO3相比较,据此解答。
A.Ca3SiO5与NH4Cl反应的方程式为:Ca3SiO5+4NH4Cl ![]() CaSiO3+2CaCl2+4NH3↑+2H2O,A正确;
CaSiO3+2CaCl2+4NH3↑+2H2O,A正确;
B.CaO能与水反应,所以需要密封保存,B正确;
C.亚硫酸的酸性比硅酸强,当二氧化硫通入到Ca3SiO5溶液时,发生反应:3SO2+H2O+ Ca3SiO5=3 CaSO3+H2SiO3,C正确;
D.盐酸的酸性比硅酸强,当盐酸与Ca3SiO5反应时,发生反应:6HCl+ Ca3SiO5=3CaCl2+H2SiO3+2H2O,D不正确;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )

A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO ![]() 4CO2+N2
4CO2+N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 | 实验现象 |
①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②向新制得的Na2S溶液中满加新制的氯水 | B.有气体产生,溶液变成浅红色 |
③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体 |
⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉锭 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究____________元素性质递变规律。
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。仪器:①__________,②__________,试管,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应实验现象的编号和②的化学方程式及此实验的结论)__________
实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
实验现象(填A~F) |
①_____________________________________,
②_____________________________________,
此实验的结论:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X(g)+3Y (g)![]() 2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
2W(g) +M (g) △H=-a kJ·mol-1(a>0)。一定温度下,在体积恒定的密闭容器中,加入1 mol X(g) 与1mol Y (g),下列说法正确的是
A. 充分反应后,放出热量为a kJ
B. 当反应达到平衡状态时,X与W的物质的量浓度之比一定为1:2
C. 当X的物质的量分数不再改变,表明该反应已达平衡
D. 若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究![]() 氧化
氧化![]() 制
制![]() 对资源综合利用有重要意义。相关的主要化学反应有:
对资源综合利用有重要意义。相关的主要化学反应有:
Ⅰ ![]()
![]()
Ⅱ ![]()
![]()
Ⅲ ![]()
![]()
Ⅳ ![]()
![]()
已知:![]() 时,相关物质的相对能量(如图1)。
时,相关物质的相对能量(如图1)。

可根据相关物质的相对能量计算反应或变化的![]() (
(![]() 随温度变化可忽略)。例如:
随温度变化可忽略)。例如: ![]()
![]() 。
。
请回答:
(1)①根据相关物质的相对能量计算![]() _____
_____![]() 。
。
②下列描述正确的是_____
A 升高温度反应Ⅰ的平衡常数增大
B 加压有利于反应Ⅰ、Ⅱ的平衡正向移动
C 反应Ⅲ有助于乙烷脱氢,有利于乙烯生成
D 恒温恒压下通水蒸气,反应Ⅳ的平衡逆向移动
③有研究表明,在催化剂存在下,反应Ⅱ分两步进行,过程如下:![]()
![]()
![]() ,且第二步速率较慢(反应活化能为
,且第二步速率较慢(反应活化能为![]() )。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从
)。根据相关物质的相对能量,画出反应Ⅱ分两步进行的“能量-反应过程图”,起点从![]() 的能量
的能量![]() ,开始(如图2)_____
,开始(如图2)_____
。

(2)①![]() 和
和![]() 按物质的量1:1投料,在
按物质的量1:1投料,在![]() 和保持总压恒定的条件下,研究催化剂X对“
和保持总压恒定的条件下,研究催化剂X对“![]() 氧化
氧化![]() 制
制![]() ”的影响,所得实验数据如下表:
”的影响,所得实验数据如下表:
催化剂 | 转化率 | 转化率 | 产率 |
催化剂X | 19.0 | 37.6 | 3.3 |
结合具体反应分析,在催化剂X作用下,![]() 氧化
氧化![]() 的主要产物是______,判断依据是_______。
的主要产物是______,判断依据是_______。
②采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高![]() 的选择性(生成
的选择性(生成![]() 的物质的量与消耗
的物质的量与消耗![]() 的物质的量之比)。在
的物质的量之比)。在![]() ,乙烷平衡转化率为
,乙烷平衡转化率为![]() ,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到
,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到![]() 。结合具体反应说明乙烷转化率增大的原因是_____。
。结合具体反应说明乙烷转化率增大的原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年12月2日,“嫦娥三号”探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察。“长征”系列火箭用偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出反应的化学方程式:_____________________________________________。
(2)该反应是________(填“放热”或“吸热”)反应,反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量,断开化学键________的总能量小于形成化学键________的总能量(填“吸收”或“放出”)。
(3)如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这个规律称为盖斯定律。据此回答下列问题。
已知:Na2CO3·10H2O(s)===Na2CO3(s)+10H2O(g)ΔH1=+532.36kJ·mol-1
Na2CO3·10H2O(s)===Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是第三周期主族元素(11~17号)某些性质变化趋势的柱形图,下列有关说法中正确的是( )
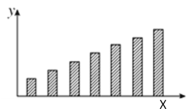
A. 若X轴为原子序数,y轴表示的可能是第一电离能
B. 若X轴为原子序数,y轴表示的可能是原子半径
C. 若X轴为最高正化合价,y轴表示的可能是电负性
D. 若X轴为族序数,y轴表示的可能是0.1mol/L最高价氧化物对应水化物溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为![]() (x=5~3,难溶于熔融硫),下列说法错误的是
(x=5~3,难溶于熔融硫),下列说法错误的是
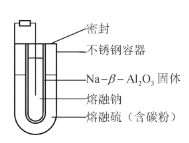
A.Na2S4的电子式为![]()
B.放电时正极反应为![]()
C.Na和Na2Sx分别为电池的负极和正极
D.该电池是以![]() 为隔膜的二次电池
为隔膜的二次电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com