
| A. | 溴苯中混有溴,加稀氢氧化钠反复洗涤、分液 | |
| B. | 乙烯中混有SO2、CO2,将其通入NaOH溶液洗气 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶 | |
| D. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
分析 A.溴与NaOH溶液反应后,与溴苯分层;
B.SO2、CO2均与NaOH溶液反应,而乙烯不能;
C.二氧化硫与碳酸氢钠溶液反应生成二氧化碳;
D.易引入新杂质氢气.
解答 解:A.溴与NaOH溶液反应后,与溴苯分层,则加稀氢氧化钠反复洗涤、分液可除杂,故A正确;
B.SO2、CO2均与NaOH溶液反应,而乙烯不能,则将其通入NaOH溶液、洗气可分离,故B正确;
C.二氧化硫与碳酸氢钠溶液反应生成二氧化碳,则气体通过盛饱和碳酸氢钠溶液的洗气瓶可分离,故C正确;
D.易引入新杂质氢气,不能除杂,应选溴水、洗气,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物的性质及应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | HClO4、H3PO4、H2SO4的酸性依次减弱 | |
| B. | HCl、HBr、HI的稳定性依次减弱 | |
| C. | N、O、F原子半径逐渐增大 | |
| D. | 钠、镁、铝的还原性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①⑥⑦②④⑤ | B. | ⑥①②⑦③④⑤ | C. | ⑤④③①⑥⑦② | D. | ⑥③⑦①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用于计算烃完全燃烧时的耗氧量 | B. | 式中的m只可能是大于0的偶数 | ||
| C. | 式中的m不可能是小于n | D. | 所表示的反应一定是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 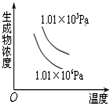 4NH3(g)+5O2(g)?4NO+6H2O(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 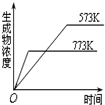 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. |  N2(g)+3H2(g)?2NH3(g);△H=-Q3kJ/mol(Q3>0) | |
| D. | 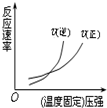 H2(g)+CO(g)?C(s)+H2O(g);△H=+Q4kJ/mol(Q4>0) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E五种元素,其相关信息如表:
有A、B、C、D、E五种元素,其相关信息如表:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层 上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com