
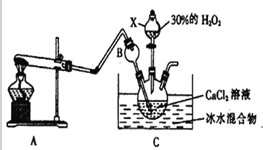
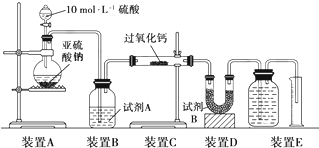
分析 (1)根据实验装置实验室中用氯化铵和氢氧化钙固体制取氧气;
(2)氨气极易溶于水,防止倒吸;
(3)CaCl2与H2O2、NH3、H2O反应生成CaO2•8H2O与NH4Cl;
(4)温度过高,过氧化氢分解速率加快,过氧化氢利用率低,该反应为放热反应,控制低温有利于CaO2•8H2O晶体的析出,提高产率;
(5)装置E量气装置导气管长进短处,不能排液体测定气体体积;
(6)试剂B的作用是吸收未反应的二氧化硫,防止对生成的氧气体积产生干扰;
(7)依据压强不变,在记录量筒中的液面位置时,除视线平视外,还应使广口瓶和量筒液面相平,才能准确测定生成气体的体积;
(8)如果假设3成立,则二氧化硫部分被氧化,则生成部分氧气,结合反应2SO2+2CaO2=2CaSO3+O2和SO2+CaO2=CaSO4计算.
解答 解:(1)根据装置为用氯化铵和氢氧化钙固体共热制取氧气,反应方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)A中产生的氨气极易溶于C中,B装置可以防倒吸;
故答案为:防倒吸;
(3)CaCl2与H2O2、NH3、H2O反应生成CaO2•8H2O与NH4Cl,离子方程式为:Ca2++H2O2+2NH3+8H2O=2NH4++CaO2•8H2O↓;
故答案为:Ca2++H2O2+2NH3+8H2O=2NH4++CaO2•8H2O↓;
(4)温度过高,过氧化氢分解速率加快,过氧化氢利用率低,该反应为放热反应,控制低温有利于CaO2•8H2O晶体的析出,提高产率,制取CaO2•8H2O一般在0~5℃的低温下进行;
故答案为:温度过高,过氧化氢分解速率加快,过氧化氢利用率低,该反应为放热反应,控制低温有利于CaO2•8H2O晶体的析出,提高产率;
(5)装置E量气装置导气管长进短处,不能排液体测定气体体积,装置E中广口瓶中的导气管应短进长出;
故答案为:装置E中广口瓶中的导气管应短进长出;
(6)装置E为测定生成气体的体积,需要把剩余的二氧化硫除去,所以试剂B的作用是吸收未反应的SO2,防止装置E中的水蒸气进入硬质玻璃管与CaO2反应;
故答案为:吸收未反应的SO2,防止装置E中的水蒸气进入硬质玻璃管与CaO2反应;
(7)依据压强不变,在记录量筒中的液面位置时,除视线平视外,还应使广口瓶和量筒液面相平,才能准确测定生成气体的体积;
故答案为:使广口瓶和量筒液面相平;
(8)如果假设3成立,则二氧化硫部分被氧化,则生成部分氧气,结合反应2SO2+2CaO2=2CaSO3+O2和SO2+CaO2=CaSO4可知,
若SO2未被氧化,发生反应方程式为:2CaO2+2SO2=2CaSO3+O2,依据化学方程式和反应增重计算E中收集的氧气:
2CaO2+2SO2=2CaSO3+O2 固体增重
1mol 96g
$\frac{V}{22.4}$mol m1g
1mol×m1g=96g×$\frac{V}{22.4}$mol,
解得:V=$\frac{7{m}_{1}}{30}$,
所以当二氧化硫部分被氧化时,则生成的氧气体积范围为:0<V<$\frac{7{m}_{1}}{30}$,
故答案为:0<V<$\frac{7{m}_{1}}{30}$.
点评 本题考查了性质实验方案的设计方法及有关范围讨论化学计算,题目难度中等,明确题干信息及实验目的为解答此类题的关键,解答过程中实验设计的步骤和实验方案的确定需要根据题干要求分析,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.4 mol/(L•s) | B. | v(B)=0.8 mol/(L•s) | C. | v(C)=1.2 mol/(L•s) | D. | v(D)=0.7 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体不均一、不稳定,静置后易产生沉淀;溶液均一、稳定,静置后不产生沉淀 | |
| B. | 布朗运动是胶体粒子特有的运动方式,可以据此将胶体与溶液、悬浊液区分开来 | |
| C. | 光线通过时,胶体发生丁达尔效应,溶液则不能发生丁达尔效应 | |
| D. | 只有胶状物如胶水、果冻类的物质才能称为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出H+的浓度c(H+):①>③ | |
| B. | 将等体积的④、⑤分别加蒸馏水稀释至pH=6,加入水的体积:④>⑤ | |
| C. | ①与③混合,若溶液pH=7,则体积:V(NaOH)>V(CH3COOH) | |
| D. | 将②与④等体积混合,得到的溶液pH>7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com