
 二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1
二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1分析 (1)3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1,反应特点为放热反应,气体系数减小的反应,依据影响反应速率因素,影响化学平衡移动因素判断解答;
(2)4H2(g)+2CO(g)═CH3OCH3(g)+H2O(g)△H1①
CO(g)+H2O(g)═CO2 (g)+H2(g)△H2=-42kJ•mol-1②
①+②得3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1,依据盖斯定律计算反应热;
依据反应前后气体系数和判断熵变;
(3)①化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积比值;
②依据t1时各物质达到平衡时浓度计算反应的平衡常数,然后计算浓度商Qc,依据Qc与K大小判断反应进行方向,判断反应速率大小;
(4)二甲醚-空气燃料电池中负极上二甲醚失电子发生氧化反应生成碳酸根离子.
解答 解:(1)a.降低温度,反应速率减慢,故a不选;
b.加入催化剂不能使平衡移动,故b不选;
c.缩小容器体积相当于加压,反应物,生成物浓度增大,反应速率加快,平衡正向移动,二甲醚的产率提高,故c选;
d.增加H2的浓度,反应速率加快,平衡正向移动,二甲醚的产率提高,故d选;
e.分离出二甲醚,反应速率降低,故e选;
故选:cd;
(2)4H2(g)+2CO(g)═CH3OCH3(g)+H2O(g)△H1①
CO(g)+H2O(g)═CO2 (g)+H2(g)△H2=-42kJ•mol-1②
①+②得3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1,依据盖斯定律得△H1=△H3-△H2=(-274KJ/mol)-(-42KJ/mol)=-232KJ/mol;
依据方程式:4H2(g)+2CO(g)═CH3OCH3(g)+H2O(g),该反应为气体系数和减小的反应,所以其熵变小于0,
故答案为:-232;>;
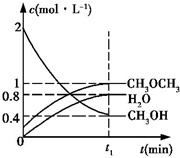
(3)①2CH3OH(g)?CH3OCH3(g)+H2O(g),平衡常数表达式为:K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$;
故答案为:=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$;
②在T1℃,恒容密闭容器中建立上述平衡,c( CH3OH)=0.4mol•L-1、c(H2O)=0.8mol•L-1、c(CH3OCH3)=1mol•L-1,则K=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=
$\frac{1×0.8}{0.4×0.4}$=5;
某时刻各组分浓度依次为:c( CH3OH)=0.4mol•L-1、c(H2O)=0.6mol•L-1、c(CH3OCH3)=1.2mol•L-1,则:Qc=$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{1.2×0.6}{0.4×0.4}$=4.5,
则Qc<K,平衡向正向移动,则正反应速率大于逆反应速率,
故答案为:$\frac{c(C{H}_{3}OC{H}_{3})c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$;>;
(4)二甲醚-空气燃料电池中负极上二甲醚失电子生成碳酸根离子,反应的电极方程式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O;
故答案为:CH3OCH3-12e-+16OH-=2CO32-+11H2O.
点评 本题考查热化学方程式和盖斯定律的分析应用,化学平衡的有关知识和化学计算,电极反应式的书写,明确盖斯定律计算反应热的方法,明确化学平衡常数的应用是解题关键,本题难度中等.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、SO42- | B. | Fe3+、K+、SO42-、NO3- | ||
| C. | H+、Mg2+、OH-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该方应的正反应吸热 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
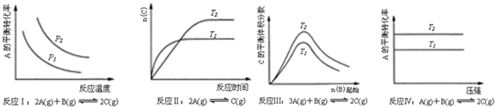
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1>T2 | ||
| C. | 反应Ⅲ:△H<0,T2>T1 | D. | 反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com