
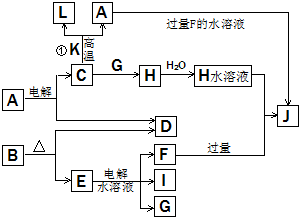
 C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系:
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系: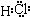 .
.分析 C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.
D的原子最外层电子数是次外层电子数的3倍,则D原子有2个电子层,最外层电子数为6,则D原子为氧原子,所以D为氧气.E的水溶液电解生成F、I、G三种物质,电解质与水都发生电解,其中I、G是短周期元素形成的气体单质,说明,E的酸根电解生成气体,应生成氯气,所以另一种气体是氢气,F为碱,E为氯化物,即I、G为氢气和氯气,F为碱,E为氯化物;加热B生成氧气与氯化物,故B应为氯酸钾,E应为氯化钾,F应为氢氧化钾;C、G同周期,且最外层电子数相差4,则G应为氯气,I应为氢气,C、G原子的最外层电子数相差4,C的最外层电子数为3,它们的简单离子电子层结构不同,则C应为Al;电解A得铝与氧气,故A应为氧化铝;C与G反应生成H,故H应为氯化铝,H的水溶液与过量F反应生成J,A与过量F溶液反应生成J,J应为偏铝酸钾;C与K高温得到A与L,则K为氧化铁,L为铁.然后再进行验证符合转化关系.
解答 解:C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的原子最外层电子数是次外层电子数的3倍,则D原子有2个电子层,最外层电子数为6,则D原子为氧原子,所以D为氧气.E的水溶液电解生成F、I、G三种物质,电解质与水都发生电解,其中I、G是短周期元素形成的气体单质,说明,E的酸根电解生成气体,应生成氯气,所以另一种气体是氢气,F为碱,E为氯化物,即I、G为氢气和氯气,F为碱,E为氯化物;加热B生成氧气与氯化物,故B应为氯酸钾,E应为氯化钾,F应为氢氧化钾;C、G同周期,且最外层电子数相差4,则G应为氯气,I应为氢气,C、G原子的最外层电子数相差4,C的最外层电子数为3,它们的简单离子电子层结构不同,则C应为Al;电解A得铝与氧气,故A应为氧化铝;C与G反应生成H,故H应为氯化铝,H的水溶液与过量F反应生成J,A与过量F溶液反应生成J,J应为偏铝酸钠;C与K高温得到A与L,则K为氧化铁或四氧化三铁,L为铁.然后再进行验证符合转化关系.
故A为氧化铝,B为氯酸钾,C为Al;D为氧气,E为氯化钾,F为氢氧化钾;G为氯气,H为氯化铝,I为氢气,J为偏铝酸钾;K为氧化铁或四氧化三铁,L为铁.
(1)D为氧气、I为氢气,D与I能形成原子个数比为1:1的共价化合物为H2O2.G为氯气,与I形成原子个数比为1:1的共价化合物为HCl,氢原子与氯原子之间形成1对共用电子对,电子式为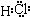 ,
,
故答案为:H2O2;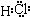 ;
;
(2)用碳棒作阳极,Fe作阴极,电解KCl水溶液,氯离子在阳极放电,生成氯气,水在阴极放电,生成氢气与氢氧根,反应的化学方程式2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+Cl2↑+H2↑.
故答案为:2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+Cl2↑+H2↑;
(3)化合物K中含有组成单质L的元素,化合物中Fe元素的质量分数为70%,则氧元素的质量分数为30%,所以化学式中铁原子与氧原子个数之比为$\frac{70%}{56}$:$\frac{30%}{16}$=2:3,所以化合物K为Fe2O3,铝与氧化铁反应生成氧化铝与铁,反应的化学方程式是 Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(4)A为氧化铝,F为氢氧化钾;J为偏铝酸钾,氧化铝与氢氧化钾反应生成偏铝酸钾与水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查结构与位置关系、无机推断、电解等,难度中等,推断物质是关键,突破口为D的原子结构与电解E的水溶液生成三种物质,其中两种为气态单质.进行推断验证,是对元素化合物知识的综合考查与对学生能力的考查.需对基础知识全面掌握,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.
三种常见短周期元素组成的化合物甲,是有机合成中的重要试剂.常温下为黄色气体,具有刺鼻恶臭味,遇水和潮气分解.标况下测定其密度为2.92g/L.浓硝酸与浓盐酸混合制王水过程中会产生少量甲气体、黄绿色气体A和水.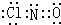 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温下,可在试管内完成焦炭和石英砂(SiO2)制取硅的反应 | |
| B. | 自然界中硅的储量丰富,仅次于氧,自然界中存在大量的单质硅 | |
| C. | 现代海战通过喷放液体SiCl4(极易水解)和液氨可产生烟幕,其主要成分是NH4Cl | |
| D. | 从燃煤烟道灰中(含GeO2)提取半导体材料单质锗(Ge),不涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
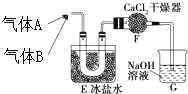
 Ⅰ.按图装置进行实验,并回答下列问题.
Ⅰ.按图装置进行实验,并回答下列问题. Ⅱ.(1)电工经常说的一句口头禅:“铜接铝,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,说明原因:铜与铝连接会构成原电池,其中铝为原电池的负极,铜为原电池的正极.构成原电池后,铝的腐蚀速度大大加快,电阻增大,放热增多,时间长了,有可能引发火灾.
Ⅱ.(1)电工经常说的一句口头禅:“铜接铝,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,说明原因:铜与铝连接会构成原电池,其中铝为原电池的负极,铜为原电池的正极.构成原电池后,铝的腐蚀速度大大加快,电阻增大,放热增多,时间长了,有可能引发火灾.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
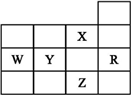
| A. | W元素气态氢化物较Y元素的气态氢化物稳定 | |
| B. | Y、Z的阴离子电子层结构都与R原子的相同 | |
| C. | p能级未成对电子最多的是Z元素 | |
| D. | X元素是非金属性最强的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水) | B. | 溴苯中的溴(苯) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 95.6%乙醇中的水(CaO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mo1•L-1NaCl溶液中含有1 mol Na+ | |
| B. | 1 mol O2的质量是32 g | |
| C. | 1 mol氢气的体积约为22.4 L | |
| D. | 标准状况下,11.2 L CH4含有10 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com