
分析 ①氟氯代烷的大量使用会导致大气平流层的臭氧,1个臭氧分子由3个氧原子构成;
②煤燃烧产生的二氧化硫会与碳酸钙分解生成的氧化钙反应生成亚硫酸钙,亚硫酸钙不稳定,被氧气氧化为硫酸钙;
③重金属离子通常采用沉淀法去除;
④明矾净水原理是铝盐水解生成了氢氧化铝胶体吸附杂质.
解答 解:①氟氯代烷的大量使用会导致大气平流层的臭氧,1个臭氧分子由3个氧原子构成,化学式为:O3;
故答案为:O3;
②煤燃烧产生的二氧化硫会与碳酸钙分解生成的氧化钙反应生成亚硫酸钙,亚硫酸钙不稳定,被氧气氧化为硫酸钙,所以向燃煤中加入石灰石,可大大减少 SO2;
故答案为:SO2;
③重金属离子镉是常见的有毒污染物,水体、土壤及生物一旦受到污染就很难去除,通常采用转化为难溶物除去,即沉淀法,
故选:B;
④明矾净水原理是硫酸铝钾溶液中含有铝离子,铝离子水解Al3++3H2O?Al(OH)3(胶体)+3H+,生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性净水,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+.
点评 本题考查了生活中的化学,侧重考查环境污染与治理,水的净化,熟悉相关知识是解题关键,题目难度不大.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:选择题
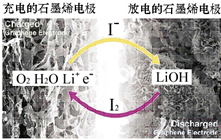 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$ 2I2+4LiOH
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$ 2I2+4LiOH| A. | 放电时负极上I- 被氧化 | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 充电时阴极反应为LiOH+e-═Li+OH- | |
| D. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
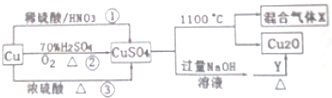
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
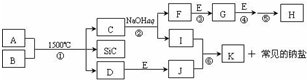 如图是一些常见元素的单质或化合物之间的转化关系.溶液中的水以及部分反应物或生成物未标出.A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物.反应③、④、⑤用于工业中生产H.
如图是一些常见元素的单质或化合物之间的转化关系.溶液中的水以及部分反应物或生成物未标出.A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物.反应③、④、⑤用于工业中生产H.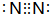 ,G的化学式NO;
,G的化学式NO;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
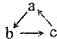 已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )
已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )| 选项 对应物质 | A | B | C | D |
| a | Cu(OH)2 | Na2O | Fe | Mg |
| b | CuCl2 | NaCl | FeCl3 | MgO |
| c | Cu | Na | FeCl2 | MgCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 现象或事实 | 解释 | |
| A | 进行中和热测定时,将NaOH溶液一次性快速倒入盛有H2SO4的量热计中 | 减少热量散失,减少测量误差 |
| B | 加热滴有酚酞试剂的纯碱溶液,溶液红色变深 | 加热促进水的电离,溶液的碱性增强 |
| C | 电解AlCl3水溶液,阴极周围出现白色胶状沉淀 | 生产的Al(OH)3胶体粒子带正电荷,发生定向移动 |
| D | 用FeCl3溶液制作印刷线路板 | FeCl3能从含有Cu2+的溶液中置换出Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com