
 ;
; ;
;| 1 |
| 2 |
| 1 |
| 2 |


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
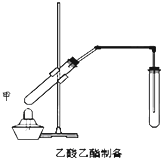 如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:
如图在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2克无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管乙中加入5ml 饱和的碳酸钠溶液,按图连接好装置,用酒精灯对试管甲小火加热3~5min后,改用大火加热,当观察到左试管中有明显现象时停止实验.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3为离子化合物 |
| B、P 与Cl可形成共价键 |
| C、SiCl4为共价化合物 |
| D、K与Mg 形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在实验室,可以用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com