
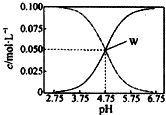
 25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )
25℃时,有均满足c(CH3COO- )+c(CH3COOH)=0.10mol/L的醋酸与醋酸钠的混合溶液系列,在溶液中c(CH3COOH)、c(CH3COO- )与pH的关系如图所示.下列有关溶液中离子浓度关系的叙述中,不正确的是( )| A. | 25℃时,醋酸的电离常数K=1.0×10-4.75 | |
| B. | W点表示的溶液中:c(CH3COO-)=c(CH3COOH)>c( Na+) | |
| C. | pH=5.5的溶液中:c(CH3COOH)>c(CH3COO- )>c(H+)>c(OH- ) | |
| D. | pH=4.0的溶液中:c( Na+)+c(H+)+c(CH3COOH)-c(OH- )=0.10mol/L |
分析 根据图象可看出,浓度增大的曲线应为c(CH3COO-),浓度减小的曲线应为c(CH3COOH),W点时c(CH3COOH)=c(CH3COO-),
A.根据电离平衡常数公式解答;
B.根据W点溶液中电荷守恒判断;
C.pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH );
D.由电荷守恒及c(CH3COOH)+c(CH3COO-)=0.1mol•L-1分析.
解答 解:A.W点c(CH3COOH)=c(CH3COO-),pH=4.75,则c(H+)=10-4.75mol•L-1,平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=10-4.75mol•L-1,故A正确;
B.溶液存在电荷守恒,应为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),W点时,溶液显酸性,则c(H+)>c(OH- ),所以W点表示的溶液中:c(CH3COO-)=c(CH3COOH)>c( Na+),故B正确;
C.随着溶液中pH增大,c(CH3COO-)增大,pH=5.5的溶液中:c(CH3COO-)>c(CH3COOH ),所以溶液中:c(CH3COO-)>c(CH3COOH )>c(H+)>c(OH- ),故C错误;
D.由电荷守恒及c(CH3COOH)+c(CH3COO-)=0.1mol•L-1可知,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=c(CH3COO-)+c(CH3COOH)=0.1mol/L,故D正确;
故选C.
点评 本题考查离子浓度大小比较,溶液中存在水解与电离两个过程的离子浓度大小比较似乎是考试热点内容,再结合守恒思想分析解答,题目难度中等.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅和二氧化碳在物理性质上有很大的差别 | |
| B. | 二氧化硅分子由一个硅原子和两个氧原子构成 | |
| C. | 工业上用二氧化硅制粗硅 | |
| D. | 二氧化硅既能与氢氟酸反应,又能与烧碱反应,但它不是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出的c(H+):④>③>①>② | |
| B. | ①、②和③等体积混合后的溶液:pH=7 | |
| C. | c(NH4+):③>④>① | |
| D. | ①和②等体积混合后的溶液:c(NH4+)+c(NH3•H2O)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
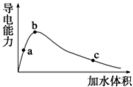 25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
25℃时,将一定量的冰醋酸(即无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )| A. | 醋酸的电离度:a<b<c | |
| B. | 溶液中c(H+):b>a>c | |
| C. | a、b、c三点的溶液都有c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 从b点到c点,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的比值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性强弱:D2>B2 | B. | D2能氧化C- | ||
| C. | 还原性强弱:A2+>B- | D. | 第二个反应中A3+是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
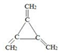
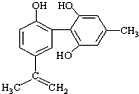 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中,正确的是( )| A. | 1mol该物质分别与浓溴水和H2反应时最多消耗和分别为4mol和7mol | |
| B. | 滴入酸性高锰酸钾溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 该物质与苯酚属于同系物,遇溶液呈紫色 | |
| D. | 该分子中的所有碳原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
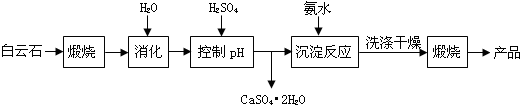
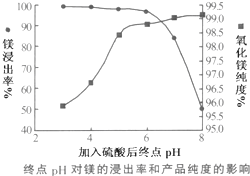
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com