
下列离子方程式正确的是( )
A.碳酸的电离:H2CO3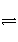
 2H++CO
2H++CO
B.将金属钠加入水中:2Na+2H2O===2Na++2OH-+H2↑
C.硫化钠水解:S2-+2H2O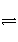
 H2S↑+2OH-
H2S↑+2OH-
D.向氯化铝溶液中加入过量的烧碱溶液:Al3++3OH-===Al(OH)3↓
科目:高中化学 来源: 题型:
据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +5、-3 | -2 |
A.GOH溶液和M(OH)3可以相互反应
B.非金属性:T<Q
C.气态氢化物的稳定性:R>T
D.L2+与T2-核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
对热化学方程式C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1最准确的理解是 ( )
A.碳和水反应吸收131.3 kJ热量
B.1 mol碳和1 mol水反应生成一氧化碳和氢气,同时放出131.3 kJ热量
C.1 mol碳和1 mol水蒸气反应生成1 mol CO和1 mol H2,同时吸收131.3 kJ热量
D.1个固态碳原子和1分子水蒸气反应吸热131.1 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH= bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能 kJ·mol-1
kJ·mol-1
D.P-P键的键能为 kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列水解离子方程式中,正确的是( )
A.Fe3++3H2O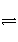
 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.Br-+H2O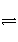
 HBr+OH-
HBr+OH-
C.CO +2H2O
+2H2O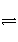
 H2CO3+2OH-
H2CO3+2OH-
D.NH +2H2O
+2H2O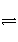
 NH3·H2O+H3O+
NH3·H2O+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于盐溶液呈酸碱性的说法错误的是( )
A.盐溶液呈酸碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中[H+]>[OH-]
C.在CH3COONa溶液中,由水电离的[OH-]≠[H+]
D.水电离出的H+和OH-与盐中弱离子结合,造成盐溶液呈酸碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,将钠与氧气反应
的生成物1.5g溶于水,所得溶液恰好能被80 mL浓度为0.5mol·L-1的HCl溶液中和,则生成物的成分是
A.Na2O B.Na2O2 C.Na2O和
B.Na2O2 C.Na2O和 Na2O2 D.Na2O2和NaO2
Na2O2 D.Na2O2和NaO2
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气。过一段时间后可观察到________________________,发生反应的化学方程式为__________________。

(2)某班同学用如图所示装置测定空气里氧气的含量。先用弹簧夹夹住橡胶管。点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察 广口瓶内水面变化情况。
广口瓶内水面变化情况。
①上述实验过程中发生 反应的化学方程式为____________________。
反应的化学方程式为____________________。
②实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的1/5,乙同学的广口瓶内水面上升明显大于瓶内空气体积的1/5。下列对这两种现象解释合理的是________。
a.甲同学可能使用钠的量不足,瓶内氧气没有消耗完
b.甲同学可能未塞紧瓶塞,钠熄灭冷却时外界空气进入瓶内
c.乙同学可能没夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管逸出
d.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
|
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 1 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)反应温度控制在30~35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入 锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com