
| 牙膏品牌 | 两面针儿童牙膏 | 中华透明牙膏 | 珍珠防臭牙膏 |
| 摩擦剂 | 氢氧化铝 | 二氧化硅 | 碳酸钙 |
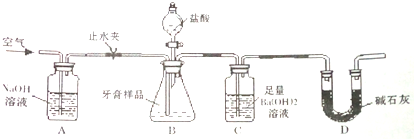
分析 (1)氢氧化铝与盐酸溶液反应生成氯化铝与水;
(2)中华透明牙膏摩擦剂二氧化硅与NaOH溶液反应生成硅酸钠和水;
(3)①防止空气中的水蒸气、二氧化碳进入装置C影响测定结果;
②二氧化碳与氢氧化钡反应生成碳酸钡与水;
③a、在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定;
b、滴加盐酸过快CO2,CO2不能完全被吸收,排出装置C.
c、在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2.
d、在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,而不影响CO2;
e、利用空气通过氢氧化钠除去二氧化碳,把剩余到装置中残留的二氧化碳赶入装置C中完全吸收,减少测定误差;
④BaCO3质量为3.94g n(BaCO3)=0.0200mol,则n(CaCO3)=0.0200mol,质量为2.00g.
⑤B中的水蒸气、氯化氢气体等进入装置C中.
解答 解:(1)氢氧化铝与盐酸溶液反应生成氯化铝与水,反应离子方程式为:Al(OH)3+3H+═Al3++3H2O,
故答案为:Al(OH)3+3H+═Al3++3H2O;
(2)中华透明牙膏摩擦剂二氧化硅与NaOH溶液反应生成硅酸钠和水,反应的化学方程式为:SiO2+2NaOH=Na2SiO3+H2O,
故答案为:SiO2+2NaOH=Na2SiO3+H2O;
(3)①试剂瓶D中碱石灰的作用是防止空气中的水蒸气、二氧化碳进入装置C中被氢氧化钡溶液吸收造成测定误差,
故答案为:防止空气中的水蒸气、二氧化碳进入装置C中被氢氧化钡溶液吸收造成测定误差;
②二氧化碳与氢氧化钡反应生成碳酸钡与水,反应方程式为CO2+Ba(OH)2═BaCO3↓+H2O.
故答案为:CO2+Ba(OH)2═BaCO3↓+H2O.
③a、在加入盐酸之前,应排净装置内的CO2气体,防止影响碳酸钡质量的测定,可以提高测定准确度,故a不符合;
b、滴加盐酸过快CO2,CO2来不及被吸收,就排出装置C,滴加盐酸不宜过快,使二氧化碳吸收完全,可以提高测定准确度,故b不符合;
c、在AB之间增添盛有浓硫酸的洗气装置,吸收水分,不影响CO2,不能提高提高测定准确度,故c符合;
d、在BC之间增添盛有饱和碳酸氢钠溶液的洗气装置Ba(OH)2,可以吸收CO2中的HCl,影响CO2,不能提高测定准确度,故d符合;
e、待B中无气泡冒出后,打开止水夹,经A装置继续通空气将装置中残余CO2排出到装置C中吸收减少测定误差,故e不符合;
故选cd,
故答案为:cd;
④BaCO3质量为3.94g,则n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol,则n(CaCO3)=0.02mol,质量为0.02mol×100g/mol=2g,所以样品中碳酸钙的质量分数为$\frac{2g}{8g}$×100%=25%.
故答案为:25%.
⑤B中的水蒸气、氯化氢气体等进入装置C中,导致测定二氧化碳的质量偏大,测定的碳酸钙的质量偏大,碳酸钙的质量分数偏高.
故答案为:B中的水蒸气、氯化氢气体等进入装置C中.
点评 本题考查对实验原理与操作步骤的理解及评价、常用化学用语、化学计算、物质组成的测定等,难度较大,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力,理解实验原理是解答的关键.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L N2和O2混合气体中所含分子数为0.5NA | |
| B. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4NA | |
| C. | 常温常压下,20g ND3中所含质子数为10NA | |
| D. | 向含0.2mol NH4Al(SO4)2的溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水使有色布条褪色 | B. | 过氧化钠使某些燃料褪色 | ||
| C. | 二氧化硫使溴水褪色 | D. | 活性炭使红墨水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离汽油和氯化钾溶液的混合液,采用分液的方法 | |
| B. | 除去NaCl溶液中混有的I2,用酒精把NaCl溶液中的I2萃取出来 | |
| C. | 除去02中混有的水蒸气,通过盛有浓硫酸的洗气瓶洗气 | |
| D. | 除去固体碘中混有的少量 Nal.采用加热升华的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道 | |
| B. | 乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键 | |
| C. | 凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形 | |
| D. | 凡AB2型的共价化合物,其中心原子A均采用sp杂化轨道成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、X | B. | X、Y、Z | C. | X、Z、Y | D. | Z、Y、X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
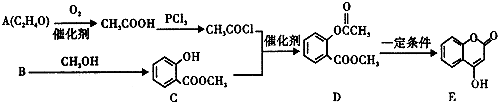
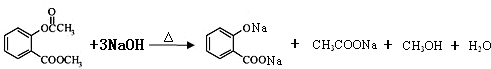 .
.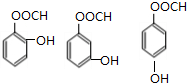 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与少量Al2(SO4)3溶液反应的离子方程式为Al3++40H-═AlO2-+2H2O | |
| B. | 该溶液中滴入酚酞变红,是因NH3•H2O?NH4++0H- | |
| C. | 该溶液中Na+、NH4+、NO3-、Mg2+可大量共存 | |
| D. | 与少量CuSO4溶液反应的离子方程式:Cu2++2NH3•H2O═Cu(OH)2↓+2NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com