
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示。若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
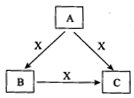

①A中所含有的化学键是_____________, X属于的晶体类型是_________。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中发生的离子反应方程式为______。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为______ g
【知识点】无机物的推断、钠的化合物 C1
【答案解析】(1)离子键和共价键 分子晶体
(2)2CO2 + 3OH- = CO32- + HCO3- + H2O
(3)2.65
解析:若A、B、C的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生,则A为氢氧化钠,B为碳酸钠,C为碳酸氢钠,X为二氧化碳,
①A为氢氧化钠,属于离子化合物,钠离子与氢氧根离子之间形成离子键,氢氧根离子中存在共价键,所以A中所含有的化学键是离子键、共价键.X为二氧化碳,是分子晶体。
②X为二氧化碳,将4.48L(标准状况下)X通入100mL 3mol•L-1A的水溶液后,n(CO2)=0.2mol,n(NaOH)=0.3mol,反应的为3NaOH+2CO2=Na2CO3+NaHCO3+H2O,离子方程式为:2CO2 + 3OH- = CO32- + HCO3- + H2O。
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5mol/L,即钠离子浓度为0.5mol/L.取相同质量的固体加热至恒重,剩余固体为碳酸钠,根据钠离子守恒可知,碳酸钠的质量为1/2×0.1L×0.5mol/L×106g/mol=2.65g.
【思路点拨】本题考查了无机物的推断,熟悉元素化合物知识是解答的前提,题目难度中等,注意焰色为突破口,利用常见元素化合物的性质结合转化关系进行解答即可.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
.下列图示与对应的叙述相符的是
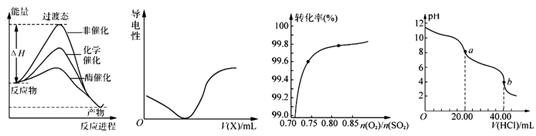
图1 图2 图3 图4
A.由图1所示曲线可知,化学催化比酶催化的效果好
B.在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X为Cl2
C.在其它条件不变时,2SO2(g)+ O2(g) 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率
2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率
D.图4是用0.l000 mol·L-1的盐酸滴定20.00 mL 0.l000mol·L-1 Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+ = CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E为原子序数依次增大的短周期元素,其中只有一种是金属元素。A、D元素原子最外层电子数相同,且A和D可形成离子化合物,C2 - 和D+ 具有相同的电子数,E元素的最高正化合价与最低负化合价之和为2。由这些元素组成的物质,其组成和结构信息如下表:

请用化学用语回答下列问题:
(1) D+ 的结构示意图为 ;
(2) C、D、E的氢化物按熔点由高到低排列的顺序为 ;
(3) 乙属于 分子(填“极性”或“非极性”),丁的电子式为 ,
(4) 将少量甲投入到AlCl3溶液中反应的离子方程式为 ;
(5) 丙属于 晶体,丙中每个原子均形成4个共价键,其中有一个配位键,提供空轨道的是 ;
氮化硼晶体的熔点要比丙晶体高,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与H2O
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
A.①③⑥⑧ B.③⑦⑧ C②⑤⑥⑦ D.①④⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
A是自然界存在最广泛的ⅡA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示:
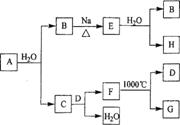
请回答下列问题:
(1)A与水反应的化学方程式为____________,E与水反应的化学方程式为___________;
(2)F的化学式为_____________,G和D的电子式分别为____________和______________;
(3)D与H反应可能生成的盐有_______________ (填化学式);
(4)如何由F制备A : 。
查看答案和解析>>
科目:高中化学 来源: 题型:
碱金属及其化合物在生活和化工生产中具有广泛的用途,下列说法正确的是
A.钠钾合金能用作原子反应堆的导热剂是由于二者是活泼金属易失电子
B.用饱和碳酸氢钠制造灭火剂比用饱和碳酸钠制造灭火剂的效果好
C.碳酸钠可用于制造洗涤剂,因为碳酸钠是碱
D.五彩缤纷的焰火是K单质燃烧所致
查看答案和解析>>
科目:高中化学 来源: 题型:
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为________。
②N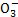 的空间构型是______(用文字描述)。
的空间构型是______(用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。
①根据等电子体原理,CO分子的结构式为________。
②H2O分子中氧原子轨道的杂化类型为________。
③1 mol CO2中含有的σ键数目为________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下判断,结论正确的是
| 选项 | 项目 | 结论 |
| A | 三种有机化合物:丙烯、氯乙烯、苯 | 分子内所有原子均在同一平面 |
| B | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | 属于同一反应类型 |
| C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
| D | C4H9Cl的同分异构体数目(不考虑立体异构) | 共有4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com