
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为:
其中第①步存在平衡2CrO42(黄色)+2H+Cr2O32(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72和CrO42的浓度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72离子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法.
该法用Fe做电极电解含Cr2O72的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生
Cr(OH)3沉淀.
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______.
【答案】橙 C 6 5 阳极反应为Fe2e═Fe2+,提供还原剂Fe2+ Fe(OH)3
【解析】
(1)溶液显酸性,c(H+)较大,上述平衡右移,该溶液显橙色;综上所述,本题答案是:橙。
(2)A.Cr2O72和CrO42的浓度相同时,反应不一定达到平衡状态,错误;
B.2v(Cr2O72)=v(CrO42),没有标出正逆反应速率,无法判定反应是否达到平衡状态,错误;
C.平衡时各物质的浓度不再改变,即溶液的颜色不再改变,可以判断反应达到平衡状态,正确;综上所述,本题选C。
(3)根据电子得失守恒可以知道,还原1molCr2O72离子,得到Cr3+,得到电子:2×(6-3)=6mol,Fe2+被氧化为Fe3+,需要FeSO47H2O的物质的量为6/(3-2)=6mol;综上所述,本题答案是:6。
(4)当c(Cr3+)=10-5mol/L时,溶液的c(OH-)=![]() =10-9mol/L,C(H+)=10-14/10-9=10-5mol/L, pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;综上所述,本题答案是:5。
=10-9mol/L,C(H+)=10-14/10-9=10-5mol/L, pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;综上所述,本题答案是:5。
(5)用Fe做阳极,发生氧化反应,失电子:Fe2e-=Fe2+,产生的亚铁离子做还原剂;综上所述,本题答案是:Fe2e-=Fe2+,提供还原剂Fe2+。
(6)溶液中氢离子在阴极得电子被还原为氢气,阴极极反应为:2H++2e-=H2↑,溶液酸性减弱,溶液pH升高,亚铁离子被氧化为铁离子,酸性减弱,铁离子产生沉淀Fe(OH)3;综上所述,本题答案是:Fe(OH)3。


科目:高中化学 来源: 题型:
【题目】下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是
①![]() ②
②![]() ③
③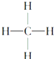 ④
④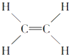 ⑤CH3CH2OH
⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯
A. 能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B. 投入钠能产生H2的是⑤⑦⑧⑨
C. 属于高分子材料的是⑧⑨⑩
D. 含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(s)+nB(g)![]() cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如图所示(T2>T1),下列叙述正确的是( )
cC(g)+fD(g)反应过程中,当其它条件不变时,C的体积分数(C%)与温度(T)和压强(P)的关系如图所示(T2>T1),下列叙述正确的是( )

A.达到平衡后,若使用催化剂,C的体积分数增大
B.达到平衡后,若使温度升高,化学平衡向逆反应方向移动
C.化学方程式中n>c+f
D.达到化学平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通立德粉(BaSO4·ZnS)广泛用于工业生产中,可利用ZnSO4和BaS共沉淀法制备。以粗氧化锌(含Zn、CuO、FeO等杂质)和BaSO4为原料制备立德粉的流程如下:
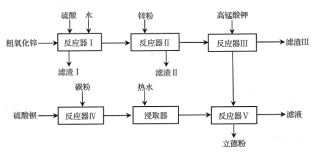
(1)生产ZnSO4的过程中,反应器Ⅰ要保持强制通风,原因是___。
(2)加入锌粉的主要目的是___(用离子方程式表示)。
(3)已知KMnO4在酸性溶液中被还原为Mn2+,在弱酸性、弱碱性溶液中被还原为MnO2,在碱性溶液中被还原为MnO42-。据流程判断,加入KMnO4时溶液的pH应调至___;
a.2.2~2.4 b.5.2~5.4 c.12.2~12.4
滤渣Ⅲ的成分为____。
(4)制备BaS时,按物质的量之比计算,BaSO4和碳粉的投料比要大于1:2,目的是__;生产过程中会有少量氧气进入反应器Ⅳ,反应器Ⅳ中产生的尾气需用碱液吸收,原因是__。
(5)普通立德粉(BaSO4·ZnS)中ZnS含量为29.4%,高品质银印级立德粉中ZnS含量为62.5%。在ZnSO4、BaS、Na2SO4、Na2S中选取三种试剂制备银印级立德粉,所选试剂为___,反应的化学方程式为__(已知BaSO4相对分子质量为233,ZnS相对分子质量为97)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的单质及化合物在研究和生产中有多种用途。根据所学知识回答下列问题:
(1)Fe3+价电子排布式为______________,并解释Fe2+还原性强的原因_______________。
(2)类卤素离子SCN-是检验Fe3+的试剂之一,与SCN-互为等电子体的一种物质的分子式 为_____________。
(3)①已知Fe3C的晶胞结构中碳原子的配位数为6,与碳原子紧邻的铁原子组成的空间构型为____________________,铁原子的配位数是___________。
②铁的某种化合物结构简式如图1所示,组成上述化合物中的第二周期元素原子的电负性由大到小的顺序为_________________________,上述化合物中氮原子的杂化方式为_____________,在图1中用“→”标出Fe元素周围的配位键_____。
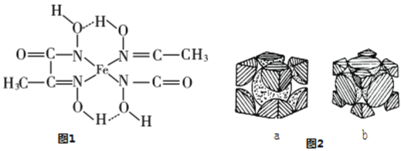
(4)铁单质的堆积方式有以下两种,其剖面图分别如图2a、b所示。其中属于面心立方最密堆积的是_______(填“a”或“b”),此晶体中原子的总体积占晶体体积的比例为____________________(用含圆周率π的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米磷化钻常用于制作特种钻玻璃,制备磷化钻的常用流程如图:
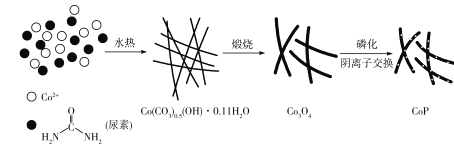
(1)基态P原子的电子排布式为___。P在元素周期表中位于___区。
(2)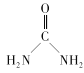 中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
中碳原子的杂化类型是___C、N、O三种元素的第一电离能由大到小的顺序是___(用元素符号表示),电负性由大到小的顺序为___。
(3)CO32-中C的价层电子对数为___,其空间构型为___。
(4)磷化钴的晶胞结构如图所示,最近且相邻两个钴原子的距离为n pm。设NA为阿伏加德罗常数的值, 则其晶胞密度为___g.cm-3(列出计算式即可)。
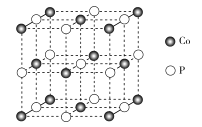
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应原理可以应用在生产上,如用于焊接钢轨等,实验室铝热反应的实验装置如图所示。
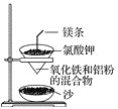
(1)镁条的作用是___。
(2)写出该反应的化学方程式:___;在冶金工业上也常用这一反应原理来冶炼__(填字母)。
A.不活泼金属 B.较活泼金属
C.稀有金属 D.高熔点金属
(3)为确定某铝热剂(含氧化铁和铝)的组成,分别进行下列实验:
①若取ag样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况,下同)体积为bL。反应的离子方程式是___;样品中铝的质量为___g。
②另取ag样品将其点燃,恰好完全反应,反应产物冷却后,加入足量盐酸,测得生成的气体体积为cL,该气体与(1)中所得气体的体积比c∶b=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,11.2 L SO2含有的氧原子数小于NA
B.0. 1 mol Na2O2和Na2O的混合物中含有的离子总数等于0.4NA
C.10 g质量分数为34%的H2O2溶液含有的氢原子数为0.2NA
D.100 mL 0.1 mol/L醋酸中含有的醋酸分子数是0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.20mol/L的NaOH溶液滴定10.00mL0.20mol/L的NaHSO3溶液,滴定过程中溶液的pH变化和滴加NaOH溶液的体积关系如图所示。下列说法错误的是( )
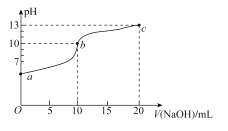
A.溶液中水的电离程度:b>a>c
B.pH=7时,消耗的V(NaOH)<10.00mL
C.在室温下K2(H2SO3)约为1.0×10-7
D.c点溶液中c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com