
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
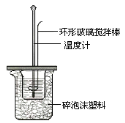
(1)大烧杯上如不盖硬纸板,求得的中和热数值___________(填“偏 大、偏小、无影响”)
(2)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等、不相等”),所求中和热__________(填“相等、不相等”),简述理由__
(3)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会______________;(填“偏大”、“偏小”、“无影响”)。
【答案】偏小 不相等 相等 因中和热是指稀酸与稀碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关 偏小
【解析】
中和热测定实验成败的关键是保温工作,反应放出的热量和所用酸以及碱的量的多少有关。
(1)中和热测定实验成败的关键是保温工作,大烧杯上如不盖硬纸板,热量损失较多,测定的热量的值偏小,所以求得的中和热数值偏小,故答案为:偏小;
(2)反应放出的热量和所用酸以及碱的量的多少有关,若用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的物质的量增多,所放出的热量增多,但中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关,中和热数值相等,即不变,故答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;
(3)NH3H2O电离过程中会吸热,所以相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会偏小,故答案为:偏小。


科目:高中化学 来源: 题型:
【题目】100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )
A. 0.20 mol·L-1B. 0.25 mol·L-1
C. 0.40 mol·L-1D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带具有从海水中富集碘的能力,从海带中提取单质碘的流程图如图:

(1)在上述操作中,哪一过程是萃取(_____)。
A.b B.c C.d D.e
(2)写出步骤d的离子方程式:____。
(3)四氯化碳能从碘水中萃取出碘的原因是(1)__(2)__,在进行萃取分液操作时,需要用到的玻璃仪器有____、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,在容积为1 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。已知:物质A、B、C、D均为气态。根据要求回答下列问题:

(1)容器中反应的化学方程式为__________________________________________。
(2)前2 min,v(A)=______mol·(L·min)-1。
(3)能说明该反应已达到平衡状态的是_____________________
A.混合气体的压强不变
B.混合体系中A、B、C、D四种物质同时存在
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=___(保留小数点后两位)。
(5)下列措施能增大该反应的反应速率的是_______________________________(填选项字母)。
A.容器容积不变,加入与反应无关的氖气
B.升高反应体系的温度
C.容器压强不变,加入与反应无关的氖气
D.把容器的体积缩小一倍
(6)T ℃时,容积为1 L的密闭容器中,起始时充入0.2 mol A、0.4 mol B、0.3 mol C、0.5 mol D,此时v(正)_______v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
a | b | ||||||||||||||||
c | d | ||||||||||||||||
e | f | g | h | i | |||||||||||||
j | k | l | m | ||||||||||||||
(1)画出k元素的原子结构示意图______________________________。
(2)写出j元素的原子核外电子排布式___________________________。
(3)写出l元素的+1价阳离子核外电子排布式___________________________。
(4)写出m元素的原子外围电子排布式___________________________,m元素位于周期表中___________周期_________族_________区。
(5)原子半径大小e___________d,第一电离能大小关系是g___________h,电负性大小关系是c___________d(以上填“>”或 “<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. b、c的最高价氧化物对应水化物可以反应
D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g) ![]() CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则

(1) 0~4 min CO的平均反应速率v(CO)=___________mol/(L.min)。
(2)达平衡时CO的转化率为____________,T1℃时该反应的平衡常数K=_______________。
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | C1 | C2 | C3 | C3 |
4 | C1 | C2 | C3 | C3 |
5 | 0.116 | 0.216 | 0.084 | C4 |
①表中3~4 min时,反应v正__________v逆(填“>”、“<”或“=”); C1___________0.08mol/L(填“>”、“<”或“=”)。
②4~5 min时,平衡向逆反应方向移动,可能的原因是__________(填字母)。
a.增加水蒸气 b.降低温度 .增大了CO2浓度 d.增加了氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍与第VA族元素形成的化合物是重要的半导体材料,其中应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态N原子的核外电子排布式为___________,基态Ga原子核外有___________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为___________和+3。砷的电负性比镓___________(填“大”或“小”)。
(3)二水合草酸镓的结构如图所示,其中镓原子的配位数为___________。

(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为___________。
(5)GaAs为原子晶体,密度为ρg·cm-3,其晶胞结构如图所示。Ga与As以___________键键合。Ga和As的原子半径分别为apm和bpm,设阿伏加德罗常数的值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为___________(列出计算式,可不化简)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构式(键线式)及球棍模型如下,该有机分子的1H核磁共振谱图如下(单位是ppm)。下列关于该有机物的叙述正确的是

A. 该有机物不同化学环境的氢原子有8种
B. 该有机物属于芳香族化合物
C. 键线式中的Et代表的基团为—CH3
D. 该有机物在一定条件下能够发生消去反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com