
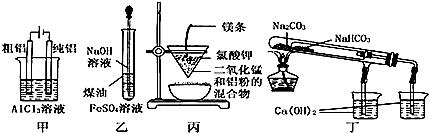
| A. | 用甲图装置电解精炼铝 | |
| B. | 用乙图装置制备 Fe(OH)2 | |
| C. | 用丙图装置可制得金属锰 | |
| D. | 用丁图装置验证 NaHCO3 和 Na2CO3的热稳定性 |
分析 A.因氧化性H+>Al3+,在阴极上不能得到Al;
B.煤油密度小于水且和水不互溶,能隔绝空气;
C.铝比锰活泼,可用铝热法冶炼;
D.NaHCO3应放在内置小试管中.
解答 解:A.因氧化性H+>Al3+,在阴极上不能得到Al,可用电解熔融氧化铝的方法,故A错误;
B.煤油可起到隔绝空气的作用,可防止氢氧化亚铁被氧化,可用于制备氢氧化亚铁,故B正确;
C.本实验为铝热法,因铝比锰活泼,可用铝热法冶炼,故C正确;
D.NaHCO3不稳定,加热易分解,而Na2CO3难分解,NaHCO3应放在内置小试管中,故D错误.
故选BC.
点评 本题考查实验方案的评价,为高频考点,涉及金属冶炼、钠的化合物稳定性强弱判断、物质制备等知识点,明确实验原理是解本题关键,注意A项为易错点,把握离子放电顺序.


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙CaCO3熟石灰 | B. | 氢氧化钠NaOH纯碱 | ||
| C. | 碳酸钠Na2CO3苏打 | D. | 碳酸氢钠NaHCO3苏打 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
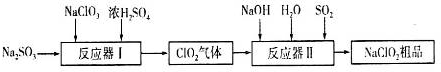
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚沾在手上,立即用氢氧化钠溶液洗涤 | |
| B. | 金属钠失火,立即用泡沫灭火器灭火 | |
| C. | 酒精灯失火后,立即用水扑灭 | |
| D. | 不慎将烧碱溶液溅到皮肤上,立即用水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
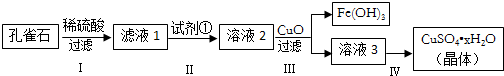
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
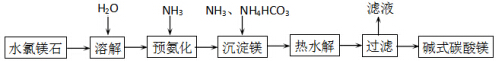
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色溶液中:NH4+、Fe2+、SO42-、CO32- | |
| B. | 在含有大量Ba2+ 的溶液中:NH4+、Na+、Cl-、CO32- | |
| C. | 在强碱性溶液中:Na+、Cl-、K+、SO42- | |
| D. | 在强酸性溶液中:K+、Fe2+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com