
| A. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| B. | Na2O的水溶液能导电,不能说明Na2O是电解质 | |
| C. | 石英和玛瑙的主要成分均为二氧化硅,其分子式为SiO2 | |
| D. | 酸性氧化物大多数是非金属氧化物,因此不能与酸溶液发生反应 |
分析 A.海水中含有电解质氯化钠,钢铁中含杂质碳等,铁、碳、氯化钠溶液形成原电池反应;
B.Na2O是活泼金属氧化物,与水反应生成氢氧化钠为电解质;
C.二氧化硅为原子晶体,不存在分子;
D.酸性氧化物大多数是非金属氧化物,如二氧化硫为酸性氧化物,能够与硝酸、氢硫酸发生氧化还原反应.
解答 解:A.海水中含有电解质氯化钠,钢铁中的铁和杂质碳在氯化钠溶液中形成原电池,铁做负极失电子被氧化,原电池能加快化学反应速率,故A错误;
B.Na2O与水反应生成电解质NaOH,氢氧化钠电离出离子溶液导电,所以Na2O的水溶液能导电,这不能说明Na2O是电解质,只有熔融状态下导电,才能说明氧化钠为电解质,故B正确;
C.二氧化硅为原子晶体,是硅原子和氧原子构成,不存在分子,没有分子式,故C错误;
D.二氧化硫为酸性氧化物,能够与硝酸、氢硫酸发生氧化还原反应,二氧化硅为酸性氧化物,和氢氟酸反应,故D错误;
故选B.
点评 本题考查了原电池原理、元素化合物知识,明确电解质、酸性氧化物的概念,注意只有分子晶体才存在分子式,题目难度不大.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO放入稀HCl中 | |
| B. | CuCl2的混合溶液中加入过量的铁粉 | |
| C. | Fe在氯气中燃烧后的产物 | |
| D. | 过量Fe粉放入FeCl3溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
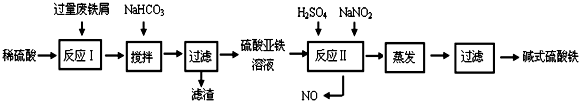
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 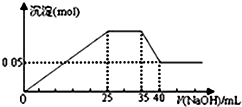 如图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol•L-1 | |
| B. |  如图中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)是,△H>0,若使用正催化剂,E值会减小 | |
| C. | 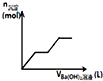 如图可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 | |
| D. | 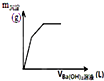 如图表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
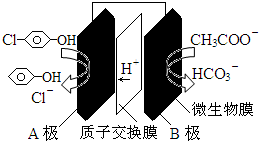
| A. | A极电极反应式为: +2e-+H+═ +2e-+H+═ +Cl- +Cl- | |
| B. | B极电极反应式为:CH3COO--8e-+4H2O═2HCO3-+9H+ | |
| C. | 溶液中的阴离子由A极向B极移动 | |
| D. | 该微生物电池在高温条件下无法正常工作 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com