
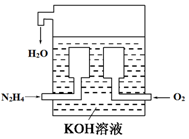
分析 (1)在肼(N2H4)燃料电池中,通入燃料气体N2H4为负极失电子发生氧化反应,阳离子移向正极;
(2)根据负极N2H4失电子发生的氧化反应及总反应计算;
(3)燃料电池的优点是能量转化率高并且排出物不污染环境.
解答 解:(1)在肼(N2H4)燃料电池中,通入燃料气体N2H4为负极失电子发生氧化反应,反应式为:N2H4+4OH--4e-=N2+4H2O,放电过程中,溶液中的阳离子移向正极,故答案为:负极;N2H4+4OH--4e-=N2+4H2O;正极;
(2)由负极反应式N2H4+4OH--4e-=N2+4H2O,则完全消耗16gN2H4,理论上外电路中转移电子的物质的量为$\frac{16g}{32g/mol}$×4=2mol,又总反应方程式为N2H4+O2=N2+2H2O,所以消耗氧气的体积为$\frac{16g}{32g/mol}$×22.4L/mol=11.2L,故答案为:2;11.2;
(3)燃料电池的优点是能量转化率高并且排出物不污染环境,故答案为:能量转化率高;排出物不污染环境.
点评 本题考查燃料电池,根据原电池原理及其方程式来分析计算解答即可,注意电极反应式的书写要结合溶液的酸碱性,为易错点.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 裂化和裂解产物中都含有不饱和烃 | |
| B. | 裂解和裂化都是为了得到气态烃 | |
| C. | 裂解和裂化的温度不同 | |
| D. | 裂化和裂解都是使相对分子质量大的烃断裂为相对分子质量小的烃的过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{A}{W+n}$(N-n)mol | B. | $\frac{W}{A+n}$(N+n)mol | C. | $\frac{W}{A+n}$(A-N+n)mol | D. | $\frac{W}{A+n}$(N-A-n)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在20~25min之间,pH=10时R的平均降解速率为0.04 mol•L-1•min-1 | |
| B. | 溶液酸性越强,R的降解速率越小 | |
| C. | R的起始浓度越小,降解速率越大 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | KMnO4溶液的浓(mol/L) | KMnO4溶液滴入的体积(mL) |
| 1 | 0.0200 | V1=20.02 |
| 2 | 0.0200 | V2=23.32 |
| 3 | 0.0200 | V3=19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气取代 | B. | 乙烯与氢气加成,再用氯气取代 | ||
| C. | 乙烯与氯化氢加成 | D. | 乙烯与氯气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中只含共价键 | |
| B. | 碳酸氢铵受热分解产生氨气不仅破坏离子键还破坏了共价键 | |
| C. | 干冰变为二氧化碳气体,因共价键被破坏需吸收能量 | |
| D. | 离子化合物中可能含有共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com