
【题目】用NA表示阿伏伽德罗常数的值.下列判断正确的是( )
A.常温常压下,44gCO2中含有的氧原子数目为2NA
B.标准状况下,22.4LH2O含有的分子数目为NA
C.1molL﹣1K2SO4溶液中含有的钾离子数目为2NA
D.1molFe在足量的Cl2中完全燃烧,转移的电子数目为2NA
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

回答下列问题:
(1)A的化学名称为__________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物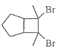 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、X存在如图所示转化关系(部分生成物和反应条件略去),若常温下A 为红棕色气体,B为强酸,X为常见金属单质。
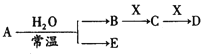
(1) C的化学式为____________。
(2) A与水反应的化学方程式为____________。
(3)某温度下(>100℃)若mgX与H2O反应放出QkJ(Q>0)的热量。写出该反应的热化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】慢心律是一种治疗心律失常的药物,它的合成路线如下:

(1)由B→C的反应类型为______________。
(2)写出A与浓溴水反应的化学方程式______________________________________。
(3)由A制备B的过程中有少量副产物E,它与B互为同分异构体,E的结构简式为________________________。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式________________。
①属于α-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有两种;
③分子中含有两个甲基。
(5)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷(![]() )写出以邻甲基苯酚(
)写出以邻甲基苯酚( )和乙醇为原料制备
)和乙醇为原料制备 的合成路线流程图(无机试剂任用)___________
的合成路线流程图(无机试剂任用)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表中第___族,其基态原子中未成对电子的个数为_________。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________,尿素分子中C、N原子的杂化方式分别是_____、___,其分子中σ键与π键的数目之比为___,所含非金属元素的电负性由大到小的顺序是_______。
(二)已知元素镓和砷的单质及其化合物在工业生产上有重要的用途。回答下列问题:
(1)砷元素基态原子的电子排布式为_____________。
(2)砷与氢元素。可形成化合物砷化氢,该化合物的空间构型为_____,其中砷原子的杂化方式为__________。
(3)根据等电子原理,写出由短周期元素组成且与砷化氢互为等电子体的一种离子的化学式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)从氯化钾溶液中得到氯化钾固体,选择装置___(填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置___。
(2)从碘水中分离出I2,选择装置____,该分离方法的名称为____。
(3)装置A中①的名称是_____,进水的方向是从_____口(填“上”或“下”)进水。装置B在分液时为使液体顺利滴下,除打开漏斗下端的旋塞外,还应进行的具体操作是______。
(4)粗盐中含Ca2+、Mg2+、Fe3+、SO42﹣等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:
①加入过量的Na2CO3溶液 ②加入过量的BaCl2溶液 ③加入过量的NaOH溶液 ④过滤 ⑤溶解 ⑥加盐酸调节溶液的pH等于7 ⑦蒸发,操作顺序合理的是_____(选填项字母)
a.⑤②③①④⑥⑦ b.⑤①②③④⑥⑦ c.⑤②①③⑥④⑦ d.⑤③②①④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为:![]() 。室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如下图所示。下列说法正确的是
。室温下,实验室里用0.1mol/L的盐酸溶液滴定10mL 0.1mol/L MOH溶液,滴定曲线如下图所示。下列说法正确的是

A. 该滴定过程可选择酚酞作为指示剂
B. C点时加入盐酸溶液的体积等于10 mL
C. 溶液中由水电离的c(H+):C点>D点
D. 若B点加入的盐酸溶液体积为5 mL,所得溶液中:c(M+)+c(H+)= c(MOH)+ c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com