
| A、配制硫酸用量筒量取硫酸时俯视刻度线 |
| B、配制盐酸定容时,仰视容量瓶刻度线 |
| C、NaOH溶解后未经冷却即注入容量瓶至刻度线 |
| D、称量4gNaOH配制0.1mol/L NaOH溶液1000ml时,砝码错放左盘 |
| n |
| V |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
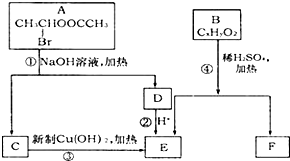 已知一个碳原子上连有两个羟基时,易发生下列转化:
已知一个碳原子上连有两个羟基时,易发生下列转化: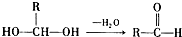
查看答案和解析>>
科目:高中化学 来源: 题型:
 第45届世界体操锦标赛于2014年10月3日至12日在广西体育中心体育馆举行.
第45届世界体操锦标赛于2014年10月3日至12日在广西体育中心体育馆举行.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气通入醋酸溶液中 CH3COOH+NH3═CH3COONH4 |
| B、澄清的石灰水跟盐酸反应 H++OH-═H2O |
| C、碳酸钡溶于醋酸 BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、金属钠跟水反应 2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
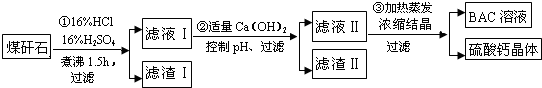
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| B、乙醇和油脂都能与氢氧化钠溶液反应 |
| C、淀粉、纤维素化学式均为(C6H10O5)n,互为同分异构体 |
| D、乙烯和苯均能与溴水发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,28gFe与足量的浓硝酸反应,转移的电子数为1.5NA |
| B、标准状况下,含4molHCl的浓盐酸与足量MnO2反应可生成22.4LCl2 |
| C、3.2g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA |
| D、常温常压下,0.1mol氖气含有的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com