
【题目】下列电离方程式中,不正确的是( )
A.HCl═H++Cl﹣
B.NH3H2O═NH4++OH﹣
C.CaCl2=Ca2++2Cl﹣
D.CH3COOHCH3COO﹣+H+
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、盐酸和K2CO3三种 试剂,按如下步骤操作:
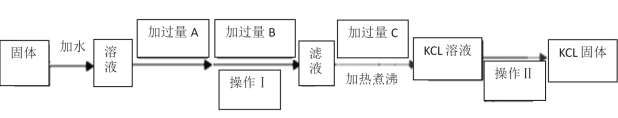
(1)图中三种试剂分别为:A__________________、 B__________________、 C___________________。
(2)加入过量A的目的是______________________________________________________________________;
加入过量B的目的是______________________________________________________________________;
加热煮沸的目的是______________________________________________________________________;
(3)操作Ⅱ的名称是______________________________。
(4)检验得到的KCl中不含有SO42-的操作________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性甲醛燃料电池为电源进行电解的实验装置如图所示,下列说法中正确的是

A. 当a、b都是铜作电极时,电解的总反应方程式为2CuSO4+2H2O![]() 2H2SO4+2Cu+O2↑
2H2SO4+2Cu+O2↑
B. 燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
C. 当燃料电池消耗22.4 L甲醛气体时,电路中理论上转移2 mol e-
D. 燃料电池工作时,负极反应为HCHO+H2O-2e-===HCOOH+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(CH≡CH)是重要的化工原料,广泛应用于焊割、燃料电池及有机合成等。
(1)乙炔-空气燃料电池是一种碱性(20%-30%的KOH溶液)燃料电池。电池放电时,负极的电极反应式为_____________;
(2)科学家利用“组合转化技术”,将乙炔燃烧产物CO2转化成乙烯,反应式为:6H2(g)+2CO2(g)![]() CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是_____(填序号)
CH2=CH2(g)+4H2O(g)下图为温度对CO2平衡转化率、催化剂催化效率的影响。下列说法正确的是_____(填序号)
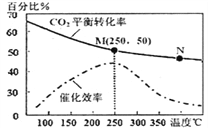
①250℃时,催化剂的催化效率最大
②随着温度升高,乙烯的产率增大
③M点平衡常数比N点平衡常数大
④N点正反应速率一定大于M点正反应速率
⑤增大压强可提高乙烯的体积分数
(3)甲烷裂解法制取乙炔的反应方程式为:2CH4(g)![]() C2H2(g)+3H2(g)。已知:
C2H2(g)+3H2(g)。已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1= a kJ·mol-1
C2H2(g)+2.5O2(g)=2CO2(g)+H2O(l) △H2= b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H3= c kJ·mol-1
则2CH4(g)![]() C2H2(g)+3H2(g) △H=______kJ·mol-1
C2H2(g)+3H2(g) △H=______kJ·mol-1
(4)哈斯特研究发现:甲烷裂解时,几种气体平衡时分压(Pa)与温度(℃)之间的关系如图所示。甲烷裂解可能发生的反应有:2CH4(g)![]() C2H2(g)+3H2(g),2CH4(g)
C2H2(g)+3H2(g),2CH4(g)![]() C2H4(g)+2H2(g)。
C2H4(g)+2H2(g)。
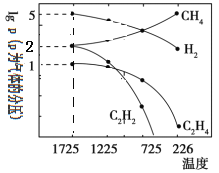
①1725℃时,向1L恒容密闭容器中充入0.3molCH4,达到平衡时,测得c(C2H2)=c(CH4)。则CH4生成C2H2的平衡转化率为_______;
②1725℃时,反应2CH4(g)![]() C2H2(g)+3H2(g)的平衡常数Kp=_________(用平衡分压代替平衡浓度);
C2H2(g)+3H2(g)的平衡常数Kp=_________(用平衡分压代替平衡浓度);
③由图可知,甲烷裂解制乙炔有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯![]() 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
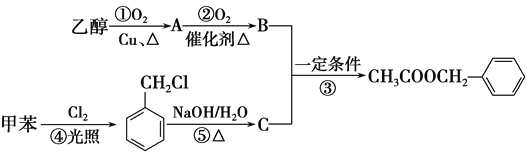
(1)B、C的结构简式分别为______________、________________。
(2)写出反应①、④的化学方程式:
①_____________________;④______________________。
(3)反应③、⑤的反应类型分别为③________,⑤____________。
(4)反应________(填序号)原子的理论利用率为100%,符合“绿色化学”的要求。
(5)乙酸苯甲酯的同分异构体中能与碳酸氢钠反应生成气体的有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分别写出乙醛与银氨溶液、苯酚钠溶液中通入少量CO2反应的离子方程式:__________________________________、__________________________________。
(2)乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):请回答下列问题:

(1)A的化学名称是_____;
(2)B和A反应生成C的化学方程式为________,该反应的类型为_____________
(3)D(环状化合物)的结构简式为___________;
(4)F的结构简式为_____________;
(5)D的同分异构体的结构简式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。
(1)已知:CO(g)+2H2(g)![]() CH3OH(g) ΔH1=-90.1kJ·mol-1;
CH3OH(g) ΔH1=-90.1kJ·mol-1;
3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) ΔH2=-31.0 kJ·mol-1。
CH3CH=CH2(g)+3H2O(g) ΔH2=-31.0 kJ·mol-1。
CO与H2合成CH3CH=CH2的热化学方程式为______________________________________。
(2)现向三个体积均为2L的恒容密闭容器Ⅰ、Ⅱ、Ⅲ中,均分别充入1molCO和2molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-90.1kJ·mol-1。三个容器的反应温度分别为T1、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) ΔH=-90.1kJ·mol-1。三个容器的反应温度分别为T1、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图1所示,其中只有一个容器中的反应已经达到平衡状态。
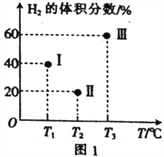
①5min时三个容器中的反应达到化学平衡状态的是容器_____________(填序号)。
②0~5min内容器Ⅰ中用CH3OH表示的化学反应速率v(CH3OH)=_________________。
③当三个容器中的反应均达到平衡状态时,CO的转化率最高的是容器____________(填序号,下同);平衡常数最小的是容器____________________。
(3)CO常用于工业冶炼金属,在不同温度下用CO还原四种金属氧化物,达到平衡后气体中lg![]() 与温度(T)的关系如图2所示。下列说法正确的是_____________(填字母)。
与温度(T)的关系如图2所示。下列说法正确的是_____________(填字母)。
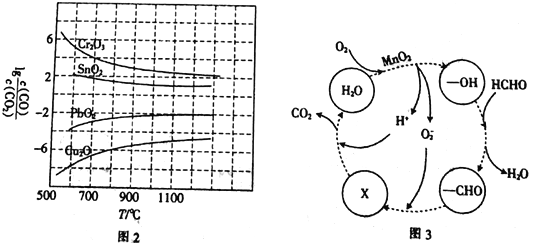
a.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量
b.CO用于工业冶炼金属铬(Cr)时,还原效率不高
c.工业冶炼金属铜(Cu)时,600℃下CO的利用率比100℃下CO的利用率更大
d.CO还原PbO2反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关下图中有机物的说法不正确的是
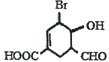
A. 该有机物的分子式为C8H9O4Br
B. 1mol该有机物最多可以与3molH2反应
C. 能发生酯化反应、水解反应、银镜反应和缩聚反应
D. 1mol该有机物与NaOH溶液反应时,最多消耗2molNaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com