


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
A、 四种基本反应类型与氧化还原反应的关系 |
B、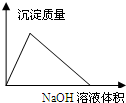 AlCl3溶液滴加NaOH溶液生成沉淀的情况 |
C、 Ba(OH)2溶液中滴加硫酸溶液导电性的情况 |
D、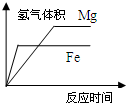 等体积等浓度稀硫酸分别与足量铁和镁反应的情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 分类方法在化学学科的发展中起了非常重要的作用.图是某反应在密闭容器中反应前后的分子状况示意图,“●”和“○”分别表示不同的原子.对此反应的分类不正确的是( )
分类方法在化学学科的发展中起了非常重要的作用.图是某反应在密闭容器中反应前后的分子状况示意图,“●”和“○”分别表示不同的原子.对此反应的分类不正确的是( )| A、化合反应 | B、氧化还原反应 |
| C、可逆反应 | D、置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 2mol/L的稀硝酸与足量铜充分反应 |
| B、100mL 1mol/L盐酸与足量锌充分反应 |
| C、20mL 10mol/L浓盐酸与足量二氧化锰加热充分反应 |
| D、0.2molCu与足量18.4mol/L浓硫酸加热充分反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 待测液的体积/mL | 滴定完成时NaOH溶液消耗的体积/mL |
| 1 | 20.00 | 17.20 |
| 2 | 20.00 | 15.98 |
| 3 | 20.00 | 16.00 |
| 4 | 20.00 | 16.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、448mL 26.2g |
| B、500mL 29.3g |
| C、1000mL 29.3g |
| D、450mL 26.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,完全燃烧2.24 L辛烷可生成CO2分子数为0.8 NA |
| B、常温常压下,30 g乙酸与30 g葡萄糖含有的氧原子数都是NA |
| C、1 mol-OH所含的电子数为17NA |
| D、1 mol Cl2通入足量的NaOH溶液中充分反应转移的电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com