
| A. | 将amol/L的Na2RO3溶液与bmol/L的NaHRO3溶液等体积混合后,若c(Na+)>c(HRO3-)>c(RO32-)>c(OH-)>c(H+),则a<b | |
| B. | 0.1mol•L-1NH4HS溶液中:c(NH4+)=c(HS-)+c(S2-)+c(H2S) | |
| C. | 若KHA溶液呈弱酸性,则c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-) | |
| D. | 向AgNO3溶液中逐滴滴加等物质的量浓度的KCl和K2CrO4的混合溶液,若先产生白色沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
分析 A.若R为碳,当a=b时,碳酸钠与碳酸氢钠混合后溶液等体积等浓度混合后显示碱性,也满足该离子浓度关系;
B.根据NH4HS溶液中的物料守恒判断;
C.由于溶液为弱酸性,则HA-的电离程度较小,c(HA-)>c(A2-);溶液中氢离子来自水的电离和HA-的电离,则c(H+)>c(A2-);
D.氯化银与铬酸银的沉淀类型不同,不能直接根据其溶度积判断溶解度大小.
解答 解:A.R为C时,等浓度的碳酸钠与碳酸氢钠溶液等体积混合后,溶液显示碱性,其碳酸氢根离子浓度大于碳酸根离子,同样满足该关系,所以a与b的关系应该为a≤b,故A错误;
B.0.1mol•L-1NH4HS溶液中,根据物料守恒可得:c(NH4+)=c(HS-)+c(S2-)+c(H2S),故B正确;
C.KHA溶液呈弱酸性,则HA-的电离程度较小:c(HA-)>c(A2-),溶液中氢离子来自水的电离和HA-的电离,则c(H+)>c(A2-),溶液中正确的离子浓度大小为:c(K+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故C错误;
D.AgCl)与Ag2CrO4的沉淀类型不同,需要通过计算才能判断其溶解度大小,不能直接根据溶度积数值大小判断难溶程度,故D错误;
故选B.
点评 本题考查了溶液中离子浓度大小比较,题目难度中等,注意掌握判断溶液中离子浓度大小的方法,选项D为易错点,注意氯化银与铬酸银为不同类型的沉淀,不能直接以溶度积大小判断其难溶情况.


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题
 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大,其中只有W为第四周期元素.X与Y基态原子的成对电子数之比为2:3,未成对电子数之比为1:1,Z是元素周期表中s区元素,但有未成对电子,R的氢化物的沸点比其上周期同族元素氢化物的沸点低,W为金属元素,Y与W形成的某种化合物与R的氢化物的浓溶液加热时反应可用于实验室制取R的气态单质,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g D2O中含有的电子数为5 NA | |
| B. | 1mol C3H8分子中共价键总数为10 NA | |
| C. | 92g NO2和N2O4混合气体中含有原子数为3 NA | |
| D. | 65gZn全部溶解在一定浓度的硝酸溶液中,有NO生成,则转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Z的电子式是
;Z的电子式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
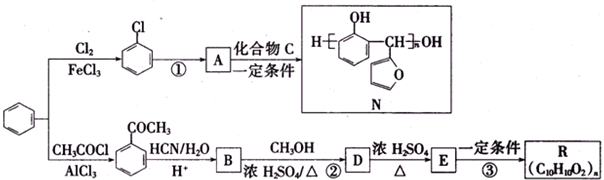
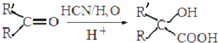
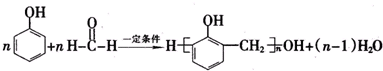
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| B. | 试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现 | |
| C. | 氢氧化钠沾到皮肤上,先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 | |
| D. | 为了减少实验误差,中和滴定用的锥形瓶必须洗净并烘干后使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于20 mL | B. | 小于20 mL | C. | 等于20mL | D. | 等于5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 496 | B. | 118 | C. | 350 | D. | 130 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3OH的燃烧热为190kJ/mol | |
| B. | 该反应说明CH3OH比H2稳定 | |
| C. | 反应中的能量变化与反应体系的温度和压强无关 | |
| D. | CO2(g)+2H2(g)→CH3OH(g)+$\frac{1}{2}$O2(g),△H=-190kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com