
| A. | ①② | B. | ①③ | C. | ①④ | D. | ①②③④ |
分析 ①温度不变,水的离子积常数不变;
②强酸弱碱盐溶液中氢离子为水电离出的氢离子;
③根据溶液酸碱性再结合电荷守恒判断离子浓度大小;
④NH4Cl水解,可促进水的电离.
解答 解:①25℃时,某NH4Cl溶液的pH为4,则溶液中c(H+)>c(OH-),故正确;
②强酸弱碱盐溶液中氢离子为水电离出的氢离子,氯化铵为强酸弱碱盐,所以溶液中水电离出的氢离子浓度为1×10-4mol/L,故错误;
③溶液呈酸性,所以c(H+)>c(OH-),溶液中存在电荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)>c(NH4+),盐类水解程度较小,所以c(NH4+)>c(H+),则溶液中离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故正确;
④NH4Cl水解,可促进水的电离,故错误.
故选B.
点评 本题考查了盐类水解,根据溶液酸碱性再结合电荷守恒来分析解答,难点是计算盐溶液中水电离出的氢离子或氢氧根离子浓度.


科目:高中化学 来源: 题型:选择题
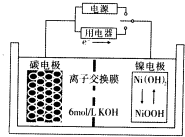 一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )
一种碳纳米管能够吸附氢气,可做二次电池(如图所示)的碳电极.该电池的电解质为6mol/LKOH溶液,下列说法正确的是( )| A. | 放电时镍电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| B. | 放电时OH-移向镍电极 | |
| C. | 充电时碳电极反应为H2-2e-+2OH-=2H2O | |
| D. | 充电时将碳电极与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | a、c两元素处在元素周期表的VIA族 | |
| B. | b、d两种元素可组成化学式为d2b2的化合物,且阴阳离子个数比为1:2 | |
| C. | c单质可在b单质中燃烧生成的化合物的分子式为cb2 | |
| D. | c的单质可用来制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
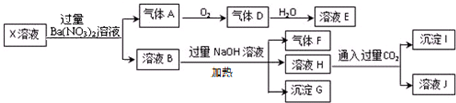
| A. | X中肯定存在Fe2+、A13+、NH4+、C1- | |
| B. | X中不能确定的离子是 K+和C1- | |
| C. | 沉淀G在空气中放置过程中,沉淀颜色会由白色变为灰绿色最后变为红褐色 | |
| D. | 标准状况下将一试管D气体倒扣在水槽中充分吸收(假设所得溶液没有扩散),所得溶液物质的量浓度约为0.036mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| A. | a、b、c、d的化学式分别为Ne、Br2、HF、H2Se | |
| B. | 系列②中各物质均只有强氧化性 | |
| C. | 系列④中各化合物的稳定性顺序为:H2O>H2S>d>H2Te | |
| D. | 系列③中各物质对应物质水溶液的酸性和还原性均逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种化合物中阴、阳离子的个数比均为1:2,且均能与水反应 | |
| B. | 根据非金属性强弱,不可能由Z的最高价氧化物制出W的最高价氧化物 | |
| C. | Y的简单氢化物的沸点和热稳定性均大于R的简单氢化物 | |
| D. | 向两份BaCl2溶液中分别通入RY2、WY2,均无白色沉淀生成,但一段时间后,通入RY2的一份中可能产生沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 电子由铁极经溶液向铂极迁移 | |
| B. | 放电过程中交换膜右侧溶液颜色逐渐变浅 | |
| C. | 正极的电极反应式为Fe3++3e-=Fe | |
| D. | 若转移2mole-,交换膜右侧溶液中约减少3mol离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com