
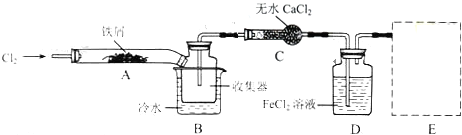
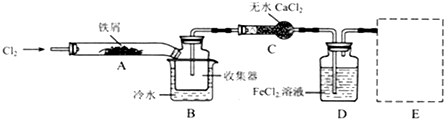
分析 本题是探究模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S的综合题型,涉及制备氯化铁时根据其易水解和受热易升华的特性,要保持无氧干燥的反应环境,并利用加热的方式防氯化铁遇冷凝华,还考查了利用Fe2+的还原性用高锰酸钾溶液检验其存在于溶液中,另外还利用氯化铁的氧化性吸收硫化氢有毒气体,利用电解反应后的溶液重新生成得到氯化铁溶液循环利用,提高原料的利用率,据此可作答.
(1)装置A中铁与氯气反应生成氯化铁;
(2)防止FeCl3潮解,不与水蒸气接触;
(3)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;装置C的名称为干燥管;检验FeCl2是否失效应检验FeCl2是否存在,可以用KMnO4溶液检验;
(4)为防止氯气的尾气污染环境,可用氢氧化钠溶液吸收,不用考虑防倒吸;
Ⅱ三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应,化学方程式为2FeCl3+H2S═2FeCl2+S↓+2HCl,再改写为离子反应方程式;
电解氯化亚铁时,阴极阳离子得到电子发生还原反应生成H2,每生成一个氢分子转移2个电子,可结合氢气的物质的量计算转移电子数目,结合绿色化学的理论并根据FeCl3可以循环利用解答.
解答 解:(1)装置A中铁与氯气反应生成氯化铁,反应为2Fe+3Cl2$\frac{\underline{\;加热\;}}{\;}$2FeCl3,故答案为:2Fe+3Cl2$\frac{\underline{\;加热\;}}{\;}$2FeCl3;
(2)为防止FeCl3潮解所采取的措施有②通入干燥的Cl2,④用干燥的N2赶尽Cl2,故答案为:②④;
(3)B 中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;装置C的名称为干燥管,酸性高锰酸钾溶液,装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,(注意“全部”字眼)检验FeCl2是否失效就是检验二价铁离子,试样中同时含有三价铁,应利用二价铁的还原性,选择酸性高锰酸钾溶液,
故答案为:B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;干燥管;酸性高锰酸钾溶液;
(4)用氢氧化钠溶液吸收含氯气的尾气,不需要考虑防倒吸,可用此装置 ,故答案为:
,故答案为: ;
;
Ⅱ发生反应为2FeCl3+H2S=2FeCl2+2HCl+S↓,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,阴极发生氢离子得电子的还原反应,2H++2e-═H 2↑,H2的体积为8.96L(标况)物质的量为$\frac{8.96L}{22.4L/mol}$=0.4mol,转移电子的物质的是为0.4mol×2=0.8mol,
电解池中最终得到的FeCl3可重新用来吸收H2S,得到循环利用,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+;0.8mol;FeCl3可以循环利用.
点评 本题是一道综合题,难度中等,考查了学生运用知识解决问题的能力,涉及到的知识点较多,掌握基础是关键.


科目:高中化学 来源: 题型:选择题
| A. | 60% | B. | 40% | C. | 33.3% | D. | 66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液导电的原因是靠自由移动的阴、阳离子 | |
| B. | 电解质在水溶液中不一定完全电离 | |
| C. | 纯净的电解质在液态时,有的导电,有的不导电 | |
| D. | 无水CuSO4不导电,但胆矾中含结晶水,所以胆矾可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常用作净水剂的KAl(SO4)2和漂白粉都是强电解质 | |
| B. | 氯气溶于水生成的次氯酸具有强氧化性,可以起到除去水中杂质和杀菌消毒作用 | |
| C. | 氮氧化物可以破坏臭氧层,也能形成酸雨 | |
| D. | “玉兔”月球车太阳能电池板可将光能转换为电能,所用转换材料是二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、Cl2+2OH-=Cl-+ClO-+H2O.
、Cl2+2OH-=Cl-+ClO-+H2O.| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液. | 溶液中出现红色. | 说明:假设②不成立,假设①或③成立; 反应的离子方程式是Fe3++3SCN-=Fe(SCN)3. |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液. | 溶液紫红色退去 | 说明:假设②或③成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 HCN+OH-
HCN+OH-查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com