
| A. | 0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA | |
| B. | 常温常压下,18.00克重水(D2O)中所含电子数约为10NA | |
| C. | 在熔融状态下1molNaHSO4所含阳离子数为2NA | |
| D. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 |
分析 A、根据反应后无论生成何种产物,镁元素的化合价均变为+2价来分析;
B、求出重水的物质的量,然后根据1mol重水中含10mol电子来分析;
C、NaHSO4在熔融状态下只能电离出钠离子和HSO4-;
D、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体.
解答 解:A、反应后无论生成何种产物,镁元素的化合价均变为+2价,即1mol镁转移2mol电子,则0.01mol镁转移0.01mol电子,与产物无关,故A正确;
B、18g重水的物质的量n=$\frac{18g}{20g/mol}$=0.9mol,而1mol重水中含10mol电子,故0.9mol重水中含9mol电子即9NA个,故B错误;
C、由于共价键在熔融状态不能断裂,故NaHSO4在熔融状态下只能电离出钠离子和HSO4-,即1molNaHSO4在熔融状态下只能电离出2mol离子即2NA个,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁分子的聚集体,故1mol氯化铁转化得到的氢氧化铁胶粒的个数小于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数数的有关计算,掌握公式的应用和物质的结构是解题关键,难度不大.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:解答题
| 转化率(%) | 0.1MPa | 0.5MPa | 1.0MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
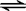 CH3COOH+OH-;
CH3COOH+OH-;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小. ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图.
pC是指极稀溶液中溶质物质的量浓度的常用对数负值,类似pH.如某溶液溶质的浓度为1×10-3 mol•L-1,则该溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3 H2CO3?H++HCO3- HCO3-?H++CO32-.如图为H2CO3、HCO3-、CO32-在加入强酸或强碱溶液后,达到平衡时溶液中三种成分的pCpH图. H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.
H++HCO3-平衡向左移动放出CO2,碳酸浓度保持不变.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应停止了 | B. | 正反应速率与逆反应速率相等 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率均为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO是一种红棕色气体,易溶于水 | |
| B. | 汽车尾气中NO的来源是空气中的N2与O2在汽车气缸内的高温环境下的反应产物 | |
| C. | 工业生产硝酸的原料主要有NO和空气 | |
| D. | 由于NO在血管中的特殊作用,所以NO无毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| B. | 向硫酸铁溶液中加入铁:Fe3++Fe═2Fe2+ | |
| C. | 在铁上镀铜阳极反应为:Cu2++2e-═Cu | |
| D. | 氯化铜水解:Cu2++2H2O?Cu(OH)2+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com