
分析 某HF溶液的pH=2,则其由水电离出的c(H+)=c(OH-)=$\frac{{K}_{W}}{1{0}^{-pH}}$;HF为弱酸,在溶液中只能部分电离出氢离子,pH=2的醋酸溶液中HF的浓度大于0.01mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L,混合液中HF过量,溶液呈酸性,据此判断反应后溶液中各离子浓度大小.
解答 解:某HF溶液的pH=2,则其由水电离出的c(H+)=c(OH-)=$\frac{{K}_{W}}{1{0}^{-pH}}$=$\frac{1{0}^{-14}}{1{0}^{-2}}$mol/L=10-12 mol/L;
氢氟酸(HF)的电离平衡常数Ka=3.6×10-4,说明HF为弱酸,在溶液中只能部分电离,则pH=2的HF溶液与pH=12的NaOH溶液混合后HF过量,反应后溶质为NaF和HF的混合液,混合液呈酸性,则 c(H+)>c(OH-),根据电荷守恒可知:c(F-)>c(Na+),溶液中离子浓度大小为:c(F-)>c(Na+)>c(H+)>c(OH-),
故答案为:10-12;c(F-)>c(Na+)>c(H+)>c(OH-).
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确弱电解质的电离特点为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:多选题
| A. | 在水溶液中或熔融状态下均不导电的化合物叫非电解质 | |
| B. | 电解质、非电解质都指化合物而言,单质不属于此范畴 | |
| C. | 电解质在水中一定能导电,在水中导电的化合物一定是电解质 | |
| D. | 纯水的导电性很差,所以水不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp | 1×10-17 | 8×10-16 | 4×10-38 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能用分液漏斗分离碘和四氯化碳的混合物 | |
| B. | 分液操作时,下层液体从分液漏斗下口放出,上层液体从上口倒出到另一个烧杯中 | |
| C. | 蒸发操作时,应使混合物中的水份完全蒸干后,才能停止加热 | |
| D. | 实验中不慎打破温度计,可用吹风机加快水银的蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
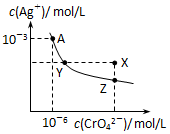 已知T℃时AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
已知T℃时AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,T℃时在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | T℃时Ag2CrO4的Ksp=2×10-12 | |
| B. | 浓度均为2×10-5mol/LAgNO3溶液与NaCl溶液等体积混合没有沉淀生成 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4固体可使溶液由Y点到X点 | |
| D. | 保持温度T℃不变,Ag2CrO4溶液长时间放置可使溶液由X点到Z点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com