
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++OH-═NH3↑+H2O | |
| B. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6 Cl- | |
| D. | 向明矾KAl(SO4)2•12H2O]溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ |
分析 A.氢氧化钾过量,铵根离子和碳酸氢根离子都参与反应;
B.醋酸为弱酸,离子方程式中醋酸不能拆开;
C.氯气足量,亚铁离子和溴离子都完全反应;
D.硫酸根离子完全沉淀时,铝离子与氢氧根离子反应生成偏铝酸根离子.
解答 解:A.KOH过量,碳酸氢根离子也参与反应,正确的离子方程式为:HCO3-+NH4++2OH-=NH3↑+2H2O+CO32-,故A错误;
B.醋酸和碳酸钙都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.向FeBr2溶液中通入足量氯气,反应生成氯化铁、溴单质,反应的离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C正确;
D.明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸钠,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
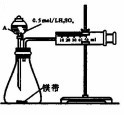 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:| 时间/s | t | 2t | … |
| 活塞的位置/mL | 25.6 | 36.0 | … |
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液中一定不含K+ | |
| B. | 分液漏斗和容量瓶在使用前都要检漏 | |
| C. | 向某溶液中加人稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| D. | 0.84g铁和50.00 mL 1.00 mol/L的稀硝酸反应,反应后溶液中一定只有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN溶液加水稀释,电离度保持不变,$\frac{c({F}^{-})}{c(HF)}$增大 | |
| B. | 向氨水中加入NH4Cl固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$增大 | |
| C. | NH4HCO3溶液呈碱性,由此可知Kb(NH3•H2O)>Ka1(H2CO3) | |
| D. | AgCl在饱和NaCl溶液中的溶解度及Ksp都比在纯水中的小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mol•L-1 的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 25℃时,10L pH=13的Ba(OH)2溶液中含有的OH-数为2NA | |
| C. | 常温常压下,11g D218O中所含中子数为6NA | |
| D. | 某无水乙醇与足量金属钠反应生成5.6L H2,则该乙醇分子中共价键总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸、硫酸铜、硫酸 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、胆矾、熟石灰 | D. | 硝酸、石灰水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
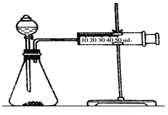 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的电子式: | B. | CCl4分子的比例模型: | ||
| C. | 乙烯与丁二烯的最简式相同 | D. | 2-甲基丁醇的结构简式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com