
【题目】石油裂解气用途广泛,由石油裂解气合成生物可降解高聚物J的合成线路如图: 
已知:
i.酯与酯可发生如下酯交换反应:RCOOR'+R″OH ![]() RCOOR″+R'OH ( R、R'、R“代表烃基)
RCOOR″+R'OH ( R、R'、R“代表烃基)
ii.烯烃中,碳碳双键相邻为不稳定结构,碳碳双键易被氧化剂氧化.
(1)A为链状烃,其核磁共振氢谱中有两组峰且面积之比是1:2,则A的名称为 .
(2)B 中所含官能团名称为 .
(3)C→D的反应类型 .
(4)C能与足量的 NaHCO3溶液反应生成C4H2O4Na2 , C的结构简式为 .
(5)D→E的化学方程式是 .
(6)H中不含甲基,H与E形成对称型高聚物J的化学方程式是 .
(7)请完成 B→C 的合理路线 . (无机试剂任选)
【答案】
(1)1,3﹣丁二烯
(2)碳碳双键、氯原子
(3)加聚反应
(4)HOOCCH=CHCOOH
(5)![]() +nCH3OH
+nCH3OH ![]()
![]() +2nH2O;
+2nH2O;
(6)2nHOCH2CH2CH2OH+ ![]()
![]()
![]() +2nCH3OH
+2nCH3OH
(7)BrCH2CH=CHCH2Br ![]() HOCH2CH=CHCH2OH
HOCH2CH=CHCH2OH ![]() HOCH2CH2CHBrCH2OH
HOCH2CH2CHBrCH2OH ![]() HOOCCH2CHBrCOOH
HOOCCH2CHBrCOOH ![]() HOOCCH=CHCOOH
HOOCCH=CHCOOH
【解析】解:(1)A为链状烃,其核磁共振氢谱中有两组峰且面积之比是1:2,A为CH2=CH﹣CH=CH2 , 则A的名称为1,3﹣丁二烯,所以答案是:1,3﹣丁二烯;(2)B为BrCH2CH=CHCH2Br,B 中所含官能团名称为碳碳双键、氯原子,所以答案是:碳碳双键、氯原子;(3)C发生加聚反应生成D,C→D的反应类型为加聚反应,所以答案是:加聚反应;(4)C能与足量的 NaHCO3溶液反应生成C4H2O4Na2 , C的结构简式为HOOCCH=CHCOOH,所以答案是:HOOCCH=CHCOOH;(5)D→E的化学方程式是 ![]() +nCH3OH
+nCH3OH ![]()
![]() +2nH2O, 所以答案是:
+2nH2O, 所以答案是: ![]() +nCH3OH
+nCH3OH ![]()
![]() +2nH2O;(6)H中不含甲基,H与E形成对称型高聚物J的化学方程式是2nHOCH2CH2CH2OH+
+2nH2O;(6)H中不含甲基,H与E形成对称型高聚物J的化学方程式是2nHOCH2CH2CH2OH+ ![]()
![]()
![]() +2nCH3OH,所以答案是:2nHOCH2CH2CH2OH+
+2nCH3OH,所以答案是:2nHOCH2CH2CH2OH+ ![]()
![]()
![]() +2nCH3OH;(7)B为BrCH2CH=CHCH2Br,C为HOOCCH=CHCOOH,B→C 的合理路线为BrCH2CH=CHCH2Br
+2nCH3OH;(7)B为BrCH2CH=CHCH2Br,C为HOOCCH=CHCOOH,B→C 的合理路线为BrCH2CH=CHCH2Br ![]() HOCH2CH=CHCH2OH
HOCH2CH=CHCH2OH ![]() HOCH2CH2CHBrCH2OH
HOCH2CH2CHBrCH2OH ![]() HOOCCH2CHBrCOOH
HOOCCH2CHBrCOOH ![]() HOOCCH=CHCOOH,所以答案是:BrCH2CH=CHCH2Br
HOOCCH=CHCOOH,所以答案是:BrCH2CH=CHCH2Br ![]() HOCH2CH=CHCH2OH
HOCH2CH=CHCH2OH ![]() HOCH2CH2CHBrCH2OH
HOCH2CH2CHBrCH2OH ![]() HOOCCH2CHBrCOOH
HOOCCH2CHBrCOOH ![]() HOOCCH=CHCOOH.
HOOCCH=CHCOOH.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列属于碱性甲醇燃料电池的正极反应,且电极反应式书写正确的是( )
A. CH3OH-6e-=CO2↑+2H2OB. O2+4e-+2H2O=4OH-
C. CH3OH+6e-=CO32-+4OH-D. O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活质量提高,废电池必须进行集中处理的问题又被提到议事日程上,其首要原因是( )
A. 利用电池外壳的金属材料
B. 回收其中石墨电极
C. 防止电池中汞、镉和铅等重金属离子对水和土壤的污染
D. 不使电池中泄漏的电解液腐蚀其他物品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2 (SO4 )3 、K2 SO4 和明矾的混合溶液中,如果c(SO4 2- )等于0.2 mol/L,当加入等体积的0.2 mol/L 的KOH溶液时,生成的沉淀恰好溶解,则原混合溶液中K + 的物质的量浓度为( )
A.0.2 mol/L
B.0.25 mol/L
C.0.45 mol/L
D.0.225 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( ) 
A.反应①为取代反应,有机产物浮在上层
B.反应②为氧化反应,反应现象是火焰明亮并伴有浓烟
C.反应③为取代反应,只生成一种产物
D.反应④中1 mol苯最多与3 mol H2发生加成反应,因为苯分子含有3个碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)电子工业常用FeCl3溶液做腐蚀液制造印刷电路板。用FeCl3做腐蚀液与Cu反应的原理为:2FeCl3+Cu=2FeCl2+CuCl2将一定量铁粉和铜粉的混合物放入等浓度的FeCl3和CuCl2的混合溶液中,可发生多个反应,其中首先发生反应的离子方程式为:。
(2)某校研究性学习小组用已生锈(Fe2O3)的废铁屑制作印刷电路板的腐蚀液(FeCl3溶液),并将刻蚀电路板后的废液再生为FeCl3溶液循环使用。实验流程如下: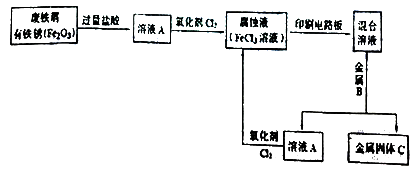
请根据使用流程写出下列反应的离子方程式:
溶液A→腐蚀液:。
混合溶液+金属B→金属固体C:。
(3)检验腐蚀液中Fe3+存在的常用试剂是 , 证明Fe3+存在的现象是。
(4)取适量混合溶液于试管中,加入一定量的铁粉,若反应结束后试管中仍有少量固体,则固体中一定含有 , 溶液中可能含有的金属阳离子是。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com