
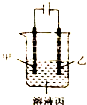
| A. | 若模拟铜的精炼原理,则乙为粗制 | |
| B. | 若模拟电镀原理,则甲为镀层金属 | |
| C. | 若模拟外加电流的阴极保护法防止金属腐蚀,则甲为被保护的金属 | |
| D. | 若甲、乙均为石墨,丙为稀硫酸,则通电一段时间后,硫酸的物质的两浓度减小 |
分析 A、铜的精炼中,粗铜作阳极,纯铜作阴极,硫酸铜溶液作电解质溶液;
B、电镀工业上,镀层作阳极,镀件作阴极;
C、外加电流的阴极保护法中,阴极是待保护金属;
D、若甲、乙均为石墨,丙为稀硫酸,即实质为电解水,所以通电一段时间后,硫酸的物质的量浓度增大.
解答 解:A、铜的精炼中,粗铜作阳极乙,纯铜作阴极甲,硫酸铜溶液作电解质溶液,故A正确;
B、电镀工业上,甲是待镀金属,乙是镀层金属,故B错误;
C、外加电流的阴极保护法中,阴极是待保护金属,即甲是待保护金属,故C正确;
D、若甲、乙均为石墨,丙为稀硫酸,即实质为电解水,所以通电一段时间后,硫酸的物质的量浓度增大,故D错误;
故选AC.
点评 本题考查了电解原理,根据电解时离子的放电顺序、电镀、电解精炼、金属的腐蚀与防护来分析解答即可,难度不大,注意原电池原理和电解池原理是高考的热点,应掌握此知识点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 活化分子间所发生的碰撞为有效碰撞 | |
| B. | 增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因之一是增加了单位体积内活化分子的百分数 | |
| D. | 有气体参与的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子总数,从而使反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2(g)+O2(g)?2SO3(g) | B. | I2(g)+H2(g)?2HI(g) | C. | CO2(g)+H2O?H2CO3 | D. | H++OH-?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8:1 | B. | 1:8 | C. | 35.5:108 | D. | 108:35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.
 .由A生成C的反应类型为消去反应.
.由A生成C的反应类型为消去反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
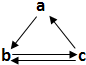 下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | a | b | c |
| A | S | SO3 | H2SO4 |
| B | Fe | FeCl2 | FeCl3 |
| C | HNO3 | NO | NO2 |
| D | CH2=CH2 | C2H5Br | C2H5OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com