
【题目】2017年2月19日在第十三届阿布扎比国际防务展上,采用先进的氢燃料电池系统的无人机,创造了该级别270分钟续航的新世界记录。下列有关氢燃料电池的说法不正确的是
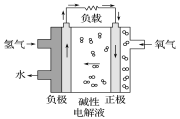
A. 通入氢气的电极发生氧化反应
B. 碱性电解液中阳离子向通入氢气的方向移动
C. 正极的电极反应式为O2+2H2O+4e-===4OH-
D. 放电过程中碱性电解液的OH-的物质的量不变
【答案】B
【解析】
氢氧燃料电池工作时,是把化学能转变为电能,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-+2OH-═2H2O,通入氧气的一极为原电池的正极,电极反应式为O2+2H2O+4e-═4OH-,阳离子向正极移动。
A. 该电池工作时化学能转化为电能,通入氢气的一极为电源的负极,发生氧化反应,A项正确;
B. 阳离子向正极移动即通入氧气的一极移动,B项错误;
C. 通入氧气的一极为原电池的正极,电极反应式为O2+2H2O+4e-===4OH-,C项正确;
D. 由图可知,氢氧燃料电池放电过程中,总反应为氢气和氧气反应生成水,则碱性电解液中氢氧根的物质的量不变,D项正确;
答案选B。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】向某无色溶液中加入BaCl2溶液,生成不溶于稀硝酸的白色沉淀,则有关溶液中含有的离子说法正确的是( )
A.一定有SO42-B.一定没有SO42-
C.一定有Ag+D.可能是SO42-,也可能是Ag+,但二者不能同时存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向PbI2饱和溶液中加水,下列叙述正确的是 ( )。
A.PbI2的溶解度增大B.PbI2的溶解度、Ksp均不变
C.PbI2的Ksp增大D.PbI2的溶解度、Ksp均减少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是短周期元素,最外层电子排布式分别为3s2,2s22p3。A与B形成的离子化合物加蒸馏水溶解后可使酚酞试液变红,同时有气体逸出,该气体可使湿润的红色石蕊试纸变蓝,则该化合物的分子量是
A. 38 B. 55 C. 100 D. 135
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2和O2反应生成2molSO3时,放出的热量为QkJ,在1L的密闭容器中进行反应2SO2(g)+O2(g)![]() 2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是( )
2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是( )
A. 某时刻,SO3的物质的量为0.28 mol,则SO2的转化率为40%
B. 反应达到平衡时放出的热量为0.1QkJ
C. 某时刻,SO2、O2、SO3的物质的量分别为0.3mol、0.15mol、0.15mol
D. 某时刻,SO3的浓度可能为0.4mol-1·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:
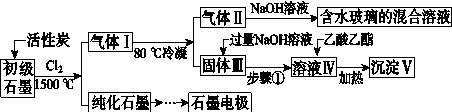
(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是 。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体Ⅰ中的碳氧化物主要为 。由气体Ⅱ中某物得到水玻璃的化学反应方程式为 。
(3)步骤①为:搅拌、 。所得溶液Ⅳ中的阴离子有 。
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为 ,
100kg初级石墨最多可能获得Ⅴ的质量为 kg。
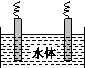
(5)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。
I.已知:氰化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)写出NaCN的电子式____________,CN-中C元素显+2价,N元素显-3价,则非金属性N_______C(填“<”“>”或“==”)(1分),请设计实验证明:__________________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是_______________________________________________________。
Ⅱ.硫代硫酸钠的工业制备的反应原理为2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
(查阅资料)ⅰ.Na2S2O3易溶于水,其稀溶液与BaCl2溶液混合物无沉淀生成。
ⅱ.Na2S2O3易被氧化;BaSO3难溶于水,可溶于稀盐酸。实验室通过如下图所示装置制备Na2S2O3。
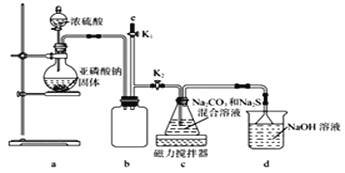
(1)实验中要控制SO2生成速率,可采取的措施有____________________ (写出一条)。
(2)b装置的作用是____________________________。
(3)反应开始后,c中先有淡黄色浑浊产生后又变为澄清,此浑浊物______(填化学式)。
(4)实验结束后,在e处最好连接盛______ (填“NaOH溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______,最后拆除装置。
(5)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀HCl、蒸馏水中选择)取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________________________。若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组配制0.10mol/LNaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475mLNaOH溶液,至少需要称量NaOH固体______g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母)____________。在配制溶液时,当快到达刻度线时如何进行定容操作_____________________。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
(3)下列情况会使所配溶液浓度偏低的是(填序号) ________________
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
⑧用量筒量取一定量浓硫酸配制稀硫酸,转移到烧杯后,用少量水洗涤量筒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com