
 开发新能源,使用清洁燃料,可以达到减少污染的目的.
开发新能源,使用清洁燃料,可以达到减少污染的目的.分析 (1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲为CO、乙为CH3OH.
①反应达到平衡后,测得c(甲)=0.2mol/L,CO为2L×0.2mol/L=0.4mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):2 6 0
转化量(mol):1.6 3.2 1.6
平衡量(mol):0.4 2.8 1.6
甲醇物质的量分数=$\frac{甲醇物质的量}{混合气体总物质的量}$;
②温度T1时平衡常数K=$\frac{\frac{1.6}{2}}{\frac{0.4}{2}×(\frac{2.8}{2})^{2}}$=2.04,升高温度到T2时,反应的平衡常数为1,平衡常数减小,说明升高温度平衡逆向移动,正反应为放热反应.
A.加入2mol甲,甲的转化率降低;
B.恒温恒容下,充入氮气,平衡不移动;
C.分离出乙,平衡正向移动;
D.升高温度平衡逆向移动;
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
根据盖斯定律,①×2-②得到:2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H=-1214.6kJ/mol,
再计算1mol甲烷不完全燃烧、完全燃烧发生热量,可得热效率关系;
(3)①负极发生氧化反应,甲烷在负极失去电子,与通过固体电解质的氧离子结合生成二氧化碳与水;
②B为电解池,铜离子发生还原反应,在阴极上析出,该极连接原电池的负极,根据转移电子计算生成Cu的物质的量,再根据m=nM计算生成Cu的质量.
解答 解:(1)由C、H、O三种元素中的两种和三种分别组成的燃料物质甲和乙,其分子中均有氧,且1个乙分子中含有18个电子,则甲为CO、乙为CH3OH,故答案为:CO、CH3OH;
①反应达到平衡后,测得c(甲)=0.2mol/L,CO为2L×0.2mol/L=0.4mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):2 6 0
转化量(mol):1.6 3.2 1.6
平衡量(mol):0.4 2.8 1.6
甲醇物质的量分数=$\frac{1.6mol}{4.8mol}$=0.33,故答案为:0.33;
②温度T1时平衡常数K=$\frac{\frac{1.6}{2}}{\frac{0.4}{2}×(\frac{2.8}{2})^{2}}$=2.04,升高温度到T2时,反应的平衡常数为1,平衡常数减小,说明升高温度平衡逆向移动,正反应为放热反应.
A.加入2molCO,CO的转化率降低,故A错误;
B.恒温恒容下,充入氮气,各组分浓度不变,平衡不移动,CO转化率不变,故B错误;
C.分离出乙,平衡正向移动,CO的转化率增大,故C正确;
D.升高温度平衡逆向移动,CO的转化率减小,故D错误,
故选:C;
(2)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-890.3kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
根据盖斯定律,①×2-②得到:2CH4(g)+3O2(g)=2CO(g)+4H2O(l)△H=-1214.6kJ/mol,
1mol甲烷不完全燃烧的热效率是完全燃烧的$\frac{\frac{1214.6kJ}{2}}{890.3kJ}$=0.7倍,
故答案为:0.7;
(3)①负极发生氧化反应,甲烷在负极失去电子,与通过固体电解质的氧离子结合生成二氧化碳与水,负极电极反应式为:CH4-8e-+4O2-=CO2+2H2O,故答案为:CH4-8e-+4O2-=CO2+2H2O;
②B为电解池,铜离子发生还原反应,在阴极析出,该极连接原电池的负极,故在b电极析出Cu,b电极的质量增重,转移0.1mol电子,析出铜的物质的量为$\frac{0.1mol}{2}$=0.05mol,故析出铜的质量为0.05mol×64g/mol=3.2g,
故答案为:b; 3.2.
点评 本题比较综合,涉及化学平衡计算、盖斯定律应用、电化学基础等,注意电化学计算中电子转移守恒应用,难度中等.


科目:高中化学 来源: 题型:解答题
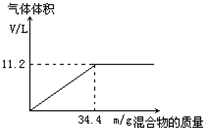 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应.如图表示加入的混合物的质量与产生的气体体积(标准状况)的关系.查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
| A. | 容器②中达平衡时放出的热量Q=23.15 kJ | |
| B. | 平衡时,两个容器中NH3的体积分数均为$\frac{1}{7}$ | |
| C. | 容器①、②中反应的平衡常数相等 | |
| D. | 若容器①体积为0.5L,则平衡时放出的热量<23.15kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ②③④⑤⑥ | C. | ④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | Mg在CO2中燃烧生成MgO和C,在该反应条件下,Mg的还原性强于C的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质依据是具有丁达尔效应 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体粒子也一定会向某一极移动 | |
| C. | 纳米材料粒子直径一般在10-9m与10-7m之间,因此纳米材料属于胶体 | |
| D. | 在江河入海处容易形成沙洲与胶体的聚沉有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com