
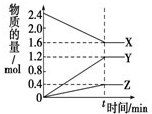
 (1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为
(1)在一个容积为2L的密闭容器中,充入1mol SO2和1mol O2,一定条件下发生反应2SO2+O2?2SO3,3分钟后测得SO3的物质的量为0.6mol,则此时O2的物质的量浓度为| △c |
| △t |
| △c |
| v |
| 0.7mol |
| 2L |
| ||
| 3min |
| △c |
| v |
| ||
| 0.06mol?L-1?s-1 |


科目:高中化学 来源: 题型:
| A、K+、Na+、Br-、SiO32- |
| B、H+、Fe2+、SO42-、Cl- |
| C、K+、Ca2+、Cl-、NO3- |
| D、K+、Al3+、NH3?H2O、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.012 kg 12C中含有约6.02×1023个碳原子 |
| B、1 mol H2O中含有2 mol氢和1 mol氧 |
| C、氢氧化钠的摩尔质量是40 g |
| D、2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6g Fe与足量稀盐酸反应转移的电子数为0.3NA |
| B、常温常压下,23g NO2含有NA个氧原子 |
| C、标准状况下,22.4L水含有个NA H2O分子 |
| D、1mol/L NaCl溶液含有NA个Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
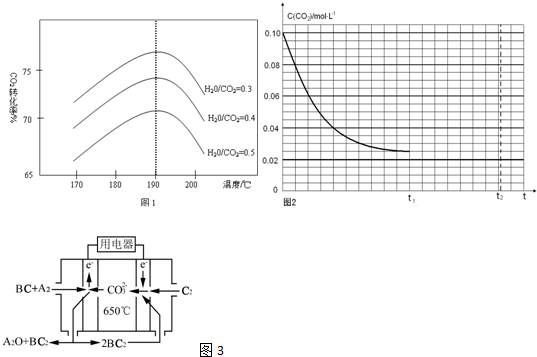
| n(H2O) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
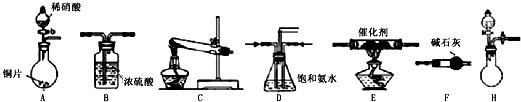
| 试剂组合序号 | 固体试剂 | NH3体积(mL) | |
| a | 6.0g Ca(OH)2(过量) | 5.4g NH4Cl | 1344 |
| b | 5.4g (NH4)2SO4 | 1364 | |
| c | 6.0g NaOH(过量) | 5.4g NH4Cl | 1568 |
| d | 5.4g (NH4)2SO4 | 1559 | |
| e | 6.0g CaO(过量) | 5.4g NH4Cl | 1753 |
| f | 5.4g (NH4)2SO4 | 1792 | |
 →
→查看答案和解析>>
科目:高中化学 来源: 题型:
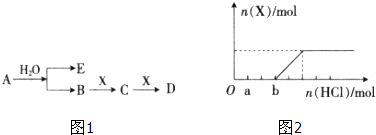
查看答案和解析>>
科目:高中化学 来源: 题型:
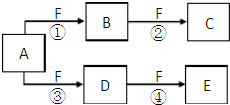 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定产生BaSO3沉淀 |
| B、一定产生BaSO4沉淀 |
| C、产生的不全是BaSO4沉淀 |
| D、一定有SO3逸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com