
【题目】用下列实验装置进行相应实验能达到实验目的的是( )
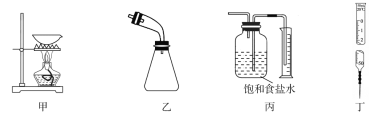
A.用甲装置从KI和I2的固体混合物中回收I2
B.用乙装置接收石油分馏实验中所得的馏分
C.用丙装置测量用MnO2和浓盐酸共热制得的Cl2体积
D.用丁装置准确量取一定体积的KMnO4标准溶液
科目:高中化学 来源: 题型:
【题目】以对羟基苯甲醛为原料,合成降血脂药物环丙贝特的流程图如下:

已知: 
请回答下列问题:
(1)下列说法不正确的是___________。
A.环丙贝特分子中存在2个手性碳原子 B. D的分子式为C14H16Cl2O3
C.C中含有的官能团有醚键、酯基和碳碳双键 D.反应②③⑤均为取代反应
(2)B的结构简式为____________ 。
(3)写出A与足量溴水反应的化学方程式为____________ 。
(4)请写出符合下列条件的A的所有同分异构体的结构简式____________ 。
i分子中含有苯环,不含其他环状结构
ii 1H-NMR谱显示共有4个峰
(5)已知:①
②苯环上有甲基时,新取代基主要取代在邻位或对位,有醛基时主要取代在间位。请写出以甲苯为原料合成![]() 的流程图,其他无机原料任选。__________________
的流程图,其他无机原料任选。__________________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取的乙烯中常混有少量的![]() ,有人设计如图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题:
,有人设计如图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题:
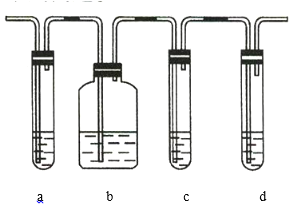
(1)图中a、b、c、d装置盛放的试剂依次是___________________(填序号)。
A.品红溶液 B.![]() 溶液 C.浓硫酸 D.酸性高锰酸钾溶液
溶液 C.浓硫酸 D.酸性高锰酸钾溶液
(2)能说明![]() 存在的实验现象是______________________________________。
存在的实验现象是______________________________________。
(3)使用装置b的目的是________________________。
(4)使用装置c的目的是________________________。
(5)能说明混合气体中含有乙烯的现象是____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以海绵铜(主要成分为Cu和CuO)为原料制取CuCl的主要流程如图所示。
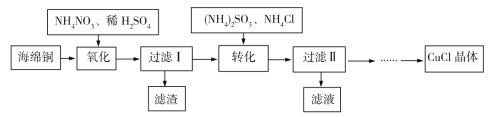
已知:①CuCl微溶于水,不溶于乙醇,可溶于氯离子浓度较大的溶液中。
②CuCl露置于潮湿的空气中易被氧化。
回答下列问题。
(1)“氧化”时温度应控制在60℃~70℃,原因是___。
(2)写出“转化”过程中的离子方程式___。
(3)“过滤Ⅱ”所得滤液经蒸发浓缩、降温结晶、过滤等操作获得(NH4)2SO4晶体,可用作化学肥料。“过滤Ⅱ”所得滤渣主要成分为CuCl,用乙醇洗涤的优点是___。
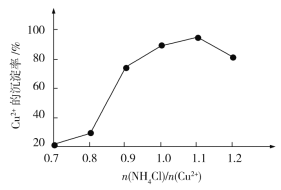
(4)氯化铵用量![]() 与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是___。
与Cu2+沉淀率的关系如图所示。随着氯化铵用量的增多Cu2+沉淀率增加,但当氯化铵用量增加到一定程度后Cu2+的沉淀率减小,其原因是___。
(5)若CuCl产品中混有少量CaSO4,设计提纯CuCl的实验方案:___。(实验中可选试剂:0.1mol·L-1盐酸、10mol·L-1盐酸、蒸馏水、无水乙醇)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气既是一种优质的能源,又是一种重要化工原料,高纯氢的制备是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,甲烷和水蒸气反应的热化学方程式是:
CH2(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=+165.0kJ·mol-1
CO2(g)+4H2(g) △H=+165.0kJ·mol-1
已知反应器中存在如下反应过程:
I.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.4kJ·mol-1
CO(g)+3H2(g) △H1=+206.4kJ·mol-1
II.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
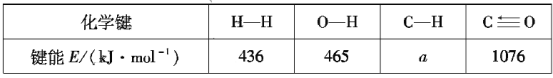
根据上述信息计算:a=___、△H2=___。
(2)某温度下,4molH2O和lmolCH4在体积为2L的刚性容器内同时发生I、II反应,达平衡时,体系中n(CO)=bmol、n(CO2)=dmol,则该温度下反应I的平衡常数K值为___(用字母表示)。
(3)欲增大CH4转化为H2的平衡转化率,可采取的措施有___(填标号)。
A.适当增大反应物投料比武n(H2O):n(CH4)
B.提高压强
C.分离出CO2
(4)H2用于工业合成氨:N2+3H2![]() 2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
2NH3。将n(N2):n(H2)=1:3的混合气体,匀速通过装有催化剂的反应器反应,反应器温度变化与从反应器排出气体中NH3的体积分数φ(NH3)关系如图,反应器温度升高NH3的体积分数φ(NH3)先增大后减小的原因是___。
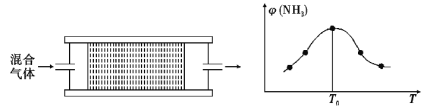
某温度下,n(N2):n(H2)=1:3的混合气体在刚性容器内发生反应,起始气体总压为2×l07Pa,平衡时总压为开始的90%,则H2的转化率为___,气体分压(p分)=气体总压(p总)×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数(记作Kp),此温度下,该反应的化学平衡常数Kp=___(分压列计算式、不化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A可以发生下列过程所示的变化:
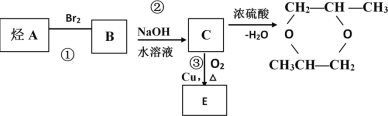
(1)烃A的结构简式是____________;
(2)反应①属_____________反应;
(3)反应②的化学方程式是________,属______反应;反应③的化学方程式是______,属_______反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g) + 2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
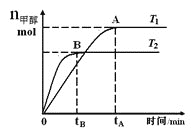
A.平衡常数K=![]()
B.该反应在T1时的平衡常数比T2时的小
C.CO合成甲醇的反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下![]() 部分操作和条件略
部分操作和条件略![]() :
:
Ⅰ![]() 从废液中提纯并结晶出
从废液中提纯并结晶出![]()
Ⅱ![]() 将
将![]() 配制成溶液.
配制成溶液.
Ⅲ![]() 溶液与稍过量的
溶液与稍过量的![]() 溶液混合,得到含
溶液混合,得到含![]() 的浊液.
的浊液.
Ⅳ![]() 将浊液过滤,用
将浊液过滤,用![]() 热水洗涤沉淀,干燥后得到
热水洗涤沉淀,干燥后得到![]() 固体.
固体.
Ⅴ![]() 煅烧
煅烧![]() ,得到
,得到![]() 固体.
固体.
已知:![]() 在热水中分解.
在热水中分解.
![]() Ⅰ中,加足量的铁屑除去废液中的
Ⅰ中,加足量的铁屑除去废液中的![]() ,该反应的离子方程式是 ______ .
,该反应的离子方程式是 ______ .
![]() Ⅱ中,需加一定量酸,该酸最好是 ______
Ⅱ中,需加一定量酸,该酸最好是 ______ ![]() 运用化学平衡原理简述该酸的作用 ______ .
运用化学平衡原理简述该酸的作用 ______ .
![]() Ⅲ中,生成
Ⅲ中,生成![]() 的离子方程式是 ______
的离子方程式是 ______ ![]() 若
若![]() 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 ______ .
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 ______ .
![]() Ⅳ中,通过检验
Ⅳ中,通过检验![]() 来判断沉淀是否洗涤干净,检验
来判断沉淀是否洗涤干净,检验![]() 的操作是 ______ .
的操作是 ______ .
![]() 已知煅烧
已知煅烧![]() 的化学方程式是
的化学方程式是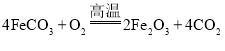 现煅烧
现煅烧![]() 的
的![]() ,得到
,得到![]() 产品.若产品中杂质只有FeO,则该产品中
产品.若产品中杂质只有FeO,则该产品中![]() 的质量是 ______
的质量是 ______ ![]() 摩尔质量
摩尔质量![]() :
:![]()
![]() 160FeO
160FeO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com