
 向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,且每一段只对应一个反应.下列说法正确的是( )| A. | 开始时产生的气体为H2 | |
| B. | AB段发生的反应为置换反应 | |
| C. | 所用混合溶液中c(HNO3)=0.5 mol•L-1 | |
| D. | 参加反应铁粉的总质量m2=5.6 g |
分析 已知氧化性:NO3->Fe3+>H+,OA段发生:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生:Fe+2Fe3+═3Fe2+,B以后发生:Fe+2H+=Fe2++H2↑,以此解答该题.
解答 解:已知氧化性:NO3->Fe3+>H+,OA段发生:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生:Fe+2Fe3+═3Fe2+,B以后发生:Fe+2H+=Fe2++H2↑,
A.开始时产生的气体为NO,故A错误;
B.AB段发生:Fe+2Fe3+═3Fe2+,为化合反应,故B错误;
C.n(NO)=$\frac{1.12L}{22.4L/mol}$=0.05mol,则所用混合溶液中c(HNO3)=$\frac{0.05mol}{0.05L}$=1mol/L,故C错误;
D.最终生成Fe2+,根据氧化还原反应中得失电子数目相等可知3×n(NO)+2×n(H2)=2n(Fe),即3×0.05mol+2×$\frac{0.56L}{22.4L/mol}$=2n(Fe),n(Fe)=0.1mol,质量为5.6g,故D正确.
故选D.
点评 本题考查混合物的计算,题目侧重于离子反应的判断和计算,注意结合离子的氧化性强弱判断反应的先后顺序,为解答该题的关键.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠与盐酸反应最剧烈,产生的氢气最多 | |
| B. | 铝与盐酸反应的速率仅次于钠,产生的气体也没有钠与盐酸反应产生气体多 | |
| C. | 铁与盐酸反应产生的气体比铝与盐酸反应产生的气体多 | |
| D. | 铝与盐酸反应和铁与盐酸反应产生的气体一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
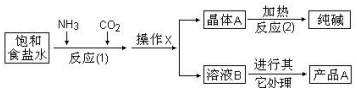
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积数据 | B. | 体积分数 | C. | 质量分数 | D. | 物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑦⑧⑨ | B. | ①②④⑥⑦⑧⑨ | C. | ①③④⑤⑥⑧⑩ | D. | ①②④⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学平衡向正向移动,反应物浓度一定降低 | |
| B. | 化学平衡向正向移动,生成物的浓度一定增加 | |
| C. | 化学平衡向正向移动,反应物的转化率一定增大 | |
| D. | 化学平衡向正向移动时,正反应速率一定大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
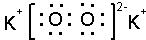 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com