
有A、B、C、D四个反应:
| 反应 | A | B | C | D |
| ΔH/(kJ·mol-1) | 10.5 | 1.80 | -126 | -11.7 |
| ΔS/(J·mol-1·K-1) | 30.0 | -113.0 | 84.0 | -105.0 |
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:填空题
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)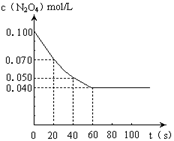
(1)计算在20至40秒时间内,NO2的平均生成速率为 mol?L-1?S -1。
(2)①该反应的化学平衡常数表达式为 。
②求该温度下平衡常数的值。(写出计算过程,下同)
(3)求达到平衡状态时N2O4的转化率。
(4)求平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。
CO(g)+3H2(g)……Ⅰ。CH4的转化率与温度、压强的关系如下图。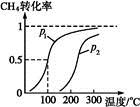
①已知100 ℃压强为p1时达到平衡所需的时间为5 min,则用H2表示的平均反应速率为 。
②图中的p1 p2(填“<”“>”或“="”),100" ℃压强为p2时平衡常数为 。
③该反应的ΔH 0(填“<”“>”或“=”)。
(2)在一定条件下,将a mol CO与3amol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g) ΔH<0 ……Ⅱ
CH3OH(g) ΔH<0 ……Ⅱ
①若容器容积不变,下列措施可增加甲醇产率的是( )
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1 mol CO和3 mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验表格中。
A.下表中剩余的实验条件数据:a= ;b= 。
。
B.根据反应Ⅱ的特点,下图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px= MPa。
| 实验编号 | T/℃ | n(CO)/n(H2) | p/MPa |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)  FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。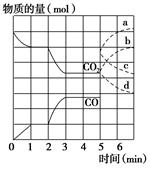
(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)=________。
(2)反应进行至2 min时,若只改变温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH________0(填“>”、“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是________(填写编号)。
a.v正先增大后减小 b.v正先减小后增大
c.v逆先增大后减小 d.v逆先减小后增大
表示n(CO2)变化的曲线是________(填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向2 L密闭容器中通入6mol气体A和6mol气体B,在一定条件下发生反应:
xA(g)+yB(g)=pC(g)+qD(g) 已知:平均反应速率v(C)=1/2v(A);反应2 min时,A的浓度减少了1mol/L,B的物质的量减少了3mol,有6mol D生成。回答下列问题:
(1)反应2 min内,v(A)= ,v(B)= ;
(2)该反应化学方程式中x:y:p:q= ;
(3)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:反应速率 (填“增大”、“减小”或“不变”),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度下某容积固定的密闭容器中加入2 mol A和1 mol B,发生如下反应:2A(g)+B(g)  3C(g)+D(s) ΔH=-Q kJ·mol-1(Q>0),当反应达到平衡后,反应放出的热量为Q1 kJ,物质A的转化率为α。请回答下列问题:
3C(g)+D(s) ΔH=-Q kJ·mol-1(Q>0),当反应达到平衡后,反应放出的热量为Q1 kJ,物质A的转化率为α。请回答下列问题:
(1)Q1________Q(填“<”、“>”或“=”),理由是__________________________。
(2)A的转化率α=________(用含Q、Q1的代数式表示);平衡后,若加入少量物质D,A的转化率会________(填“增大”、“减小”或“不变”)。
(3)反应达到平衡后,若升高温度,K________(填“增大”、“减小”或“不变”),混合气体的平均相对分子质量________(填“增大”、“减小”或“不变”)。
(4)维持温度不变,若起始时向容器中加入的物质如下列四个选项,则反应达到平衡后放出的热量仍为Q1 kJ的是(稀有气体不参与反应)________(填字母)。
A.2 mol A、1 mol B、1 mol Ar
B.3 mol C、1 mol D
C.1 mol A、0.5 mol B、1.5 mol C、0.5 mol D
D.2 mol A、1 mol B、1 mol D
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知该反应速率随着溶液中c(H+)的增大而加快。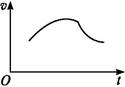
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率减慢的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
液氨常用作制冷剂,回答下列问题
(1)一定条件下在密闭容器中发生反应:
a.NH4I(s)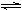 NH3(g) + HI(g) b.2HI(g)
NH3(g) + HI(g) b.2HI(g) 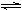 H2(g) + I2(g)
H2(g) + I2(g)
①写出反应a的平衡常数表达式
②达到平衡后,扩大容器体积,反应b的移动方向 (填“正向”、“逆向”或“不移动”),达到新的平衡时容器内颜色将怎样变化 (填“加深”、“变浅”或“不变”)
(2)工业上合成氨的反应:N2(g)+3H2(g) 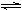 2NH3(g) ΔH=-92.60 kJ·mol-1
2NH3(g) ΔH=-92.60 kJ·mol-1
下列说法能说明上述反应向正反应方向进行的是________(填序号)。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量增大
e.容器内的气体密度不变
(3)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A)∶c(B)=3∶5,C的平均反应速率为0.1mol/(L·min)。求:
(1)此时A的浓度c(A)=________mol/L,反应开始前容器中的A、B的物质的量:n(A)=n(B)=________mol。
(2)B的平均反应速率:v(B)=________mol/(L·min)。
(3)x的值为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com