
| A. | 电子层 | B. | 电子层和能级 | ||
| C. | 电子层、能级和原子轨道空间分布 | D. | 原子轨道空间分布和电子自旋方向 |
分析 在多电子原子中,轨道能量是由主量子数和角量子数决定,即由电子能层和电子能级决定,据此分析.
解答 解:在多电子原子中,轨道能量是由主量子数和角量子数决定,n 代表主量子数,主要是决定原子的电子占据哪个电子能层.主量子数越大则电子占据更高的电子能层,原子的能量越高;主量子数越小则电子占据更低的电子能层,原子的能量越低;
l 代表角量子数,主要决定原子的电子占据同一个电子层的哪个亚电子层.主量子数相同时,电子都处在同一个电子层.此时,角量子数越大,则电子占据更高的能级,原子的能量越高;角量子数越小,则电子占据更低的能级,原子的能量越低;
所以轨道能量由电子能层和电子能级决定;
故选B.
点评 本题考查了在多电子原子中决定轨道能量的因素,属于基础知识的考查,难度不大,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
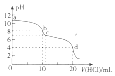 常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )
常温下,用0.1mol•L-1的HC1溶液滴定10m L 0.1mol•L-1的Na2CO3溶液,滴定曲线如图所示.下列说法正确的是( )| A. | 该滴定过程应选择酚酞作指示剂 | |
| B. | a点时,溶液中存在:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| C. | b点时,溶液中存在:c(CO32-)+c(HCO3-)+c( H2CO3)=0.05 mol•L-1 | |
| D. | d点时,溶液中存在电离平衡:H2CO3?2 H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.
H2O2广泛应用于化学品合成、纸浆和纺织品的漂白,是环保型液体漂白剂.有研究表明,H2O2溶液的漂白性是HO2-所致.| 初始pH | pH=10 | pH=12 |
| 1小时后H2O2溶液浓度 | 0.13mol•L-1 | 0.07mol•L-1 |
| 1小时后pH | 没有明显变化 | 没有明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
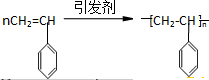
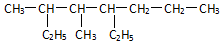 的系统命名为3,4-二甲基-5-乙基辛烷.若该烷烃是由某炔烃与H2发生加成反应而得到的产物,则符合题意的炔烃分子有4种.
的系统命名为3,4-二甲基-5-乙基辛烷.若该烷烃是由某炔烃与H2发生加成反应而得到的产物,则符合题意的炔烃分子有4种. ,现有一种有机物X的键线式如图所示:
,现有一种有机物X的键线式如图所示: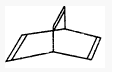
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 甲 | 乙、丙、丁 |
| A | 纯净物 | 液氯、KAl(SO4)2、CuSO4•5H2O |
| B | 能导电 | Fe、NaCl晶体、AgCl |
| C | 碱 | 一水合氨、NaOH、纯碱 |
| D | 电解质 | 盐酸、硫酸、硝酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单晶硅是重要的半导体材料,可用于制造光导纤维 | |
| B. | 钠是一种强还原剂,可以将钛、铌等金属从其熔融的氯化物中置换出来 | |
| C. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 | |
| D. | Fe、Cu分别与Cl2反应,均生成高价氯化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
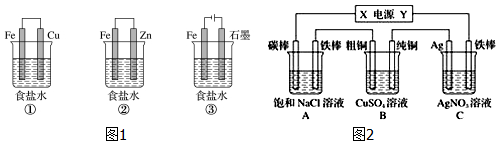
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com