
下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作阳极,铁片作阴极,电解ZnCl2溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
下列各醇能发生消去反应生成不饱和化合物的是 ----------------------------------------( )
A.CH3OH B.C2H5OH
C .
.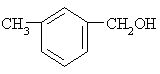 D.
D.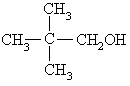
查看答案和解析>>
科目:高中化学 来源: 题型:
某制药厂用两种石油裂解气C4H8和C2H4以及 合成一种药物K,其合成路线设计如下:
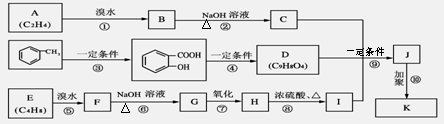 |
其中G无酸性,H、I有酸性;D可与NaHCO3溶液作用生成气体,并遇FeCl3溶液不显紫色;K的分子式为(C15H16O6)n。请完成下列各题:
(1)上述过程中属于取代反应的是 。(2)写出结构简式:E ,K 。
(3)写出下列反应的化学方程式:B→C: 。H→I: 。
(4)写出I的属于链状酯类且其核磁共振氢谱中有三个吸收峰的同分异构体的结构简式 。(任写2个)
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中, 正确的是( )
正确的是( )
A.原子序数:A>B>C
B.原子半径:A>B>C
C.离子半径:A2->B2+>C-
D.原子最外层电子数:A>C>B
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,pH=3的盐酸a L分别与下列三种溶液充分混合后,溶液均呈中性:
①c(NH3·H2O)=10-3 mol·L-1的氨水b L,②c(OH-)=10-3 mol·L-1的氨水c L,③c(OH-)=10-3 mol·L-1的Ba(OH)2溶液d L。试判断a、b、c、d的数量大小关系为( )
A.a=b>c>d B.b>a=d>c C.b>a>d>c D.c>a=d>b
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO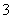 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH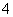 )=c(Cl-)
)=c(Cl-)
D.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如图所示。
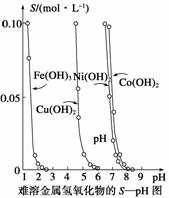
(1)pH=3时溶液中铜元素的主要存在形式是____________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是____________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:________________________。
(5)已知一些难溶物的溶度积常数如下表。
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________(填选项)。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
科目:高中化学 来源: 题型:
聚甲基丙烯酸甲酯是一种重要的医用高分子材料,用于人造骨、关节等,已知烯烃可被KMnO4酸性溶液氧化成二元醇,如CH2===CH2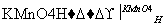 HOCH2CH2OH。
HOCH2CH2OH。
现以甲基丙烯为原料合成甲基丙烯酸甲酯,流程如下:
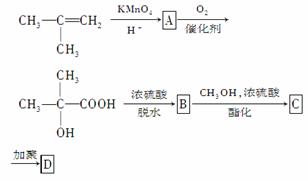
请写出上面方框中各有机物的结构简式:
A.________________,B.________________,
C.________________,D.________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 在25℃、101 kPa下,1 g甲烷完全燃烧后,恢复到原状态放热Q kJ,
则表示甲烷燃烧热的热化学方程式为_________________
(2)肼(N2H4)一空气燃料电池是一种碱性环保电池,该电池放电时,负极的反应式为 。
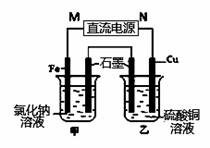 (3)如右图装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为 (选填“变大”、“变小”、“不变”)。通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入 (填序号).
(3)如右图装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为 (选填“变大”、“变小”、“不变”)。通电一段时间后(溶液中还有CuSO4),若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入 (填序号).
A.CuO B.Cu(OH)2 C.CuCO3 D.Cu2(OH)2CO3
(4)右图是用于笔记本电脑的甲醇(CH3OH)燃料电池结构示意图,质子交换膜左右两侧的溶液均为500mL 2 mol/LH2SO4 溶液,当电池中有1mol e-发生转移时,左右两侧溶液的 质量之差为 (忽略气体的溶解,假设反应物完全耗尽)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com