
【题目】化合物环丁基甲酸(H)是一种应用广泛的有机物,合成化合物H的路线如图:
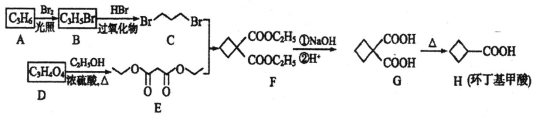
(1)A属于烯烃,其结构简式为______________,由A→B的反应类型是___________。
(2)D中官能团的名称是_________________,由D→E的反应类型是________________。
(3)E的名称是_______________。
(4)写出F与NaOH溶液反应的化学方程式_______________________。
(5)M是G的同分异构体,且满足以下条件:①能使溴的四氯化碳溶液褪色;②1mol M与足量饱和NaHCO3反应产生88g气体;③核磁共振氢谱为2组峰;则M的结构简式为(不考虑立体异构,只写一种)________________,N是比M少一个碳原子的同系物,则N的同分异构体有_________种。
(6)参照上述合成路线,以![]() 和化合物E为原料(无机试剂任选),设计制备
和化合物E为原料(无机试剂任选),设计制备![]() 的合成路线________________________________。
的合成路线________________________________。
【答案】CH2=CHCH3 取代反应 羧基 酯化反应(取代反应) 丙二酸二乙酯 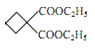 +2NaOH
+2NaOH![]()
![]() +2 C2H5OH (CH3)2C=C(COOH)2 或HOOC(CH3)C=C(CH3)COOH 5
+2 C2H5OH (CH3)2C=C(COOH)2 或HOOC(CH3)C=C(CH3)COOH 5 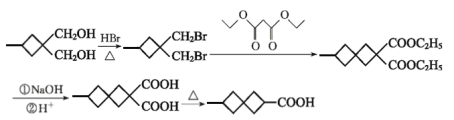
【解析】
A为烯烃,根据分子式易知为丙烯CH2=CH-CH3,丙烯与Br2在光照条件下可得CH2=CH-CH2Br,D和乙醇酯化的E,反过来E水解得到D和乙醇,那么结合D分子式可知结构简式为HOOCCH2COOH。
(1)A为烯烃,根据分子式易知为丙烯CH2=CH-CH3,丙烯与Br2在光照条件下可得CH2=CH-CH2Br,该反应为取代反应;
(2)D的结构简式为HOOCCH2COOH,D中官能团的名称是羧基,根据D为酸,乙醇为醇可知由D→E的反应类型是酯化反应(取代反应);
(3)D为丙二酸,1分子丙二酸与2分子乙醇酯化得到E,E的名称为丙二酸二乙酯;
(4)F中含有酯基,F与NaOH溶液发生酯类的水解反应,则反应方程式为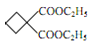 +2NaOH
+2NaOH![]()
![]() +2 C2H5OH;
+2 C2H5OH;
(5)G的分子式为C6H8O4,且不饱和度为3,根据1mol M与足量饱和NaHCO3反应产生88g气体,说明M含有羧基,那么88g气体为2molCO2,说明M有两个羧基,占用了分子中的2个不饱和度,剩下一个,又M能使溴的四氯化碳溶液褪色,说明必定只含有一个碳碳双键(不存在环状结构),考虑到M核磁共振氢谱为2组峰,那么M可能的结构简式为(CH3)2C=C(COOH)2 或HOOC(CH3)C=C(CH3)COOH;N是比M少一个碳原子的同系物,则分子式为C5H6O4,注意N和M的官能团数目和种类完全相同,则N的同分异构体分别为![]() 、
、![]() 、
、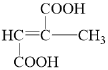 、
、![]() 、
、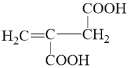 ,合计共有5种;
,合计共有5种;
(6)![]() 相对于
相对于![]() 多了一个环,根据题干合成路线分析可知,该成环过程即C和E合成F的过程以及后续反应过程,而C为卤代烃,因而可将
多了一个环,根据题干合成路线分析可知,该成环过程即C和E合成F的过程以及后续反应过程,而C为卤代烃,因而可将![]() 与HBr反应生成,因而该路线设置为
与HBr反应生成,因而该路线设置为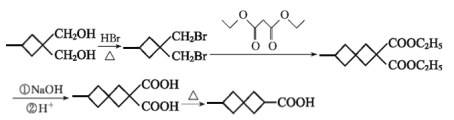 。
。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料,由A制备聚合物C和 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。

已知: ,
,![]() R-COOH
R-COOH
(1)A的名称是_____________;B中含氧官能团名称是________________。
(2)C的结构简式________________;D→E的反应类型为________________
(3)E→F的化学方程式为___________________________。
(4)B的同分异构体中,与B具有相同官能团且能发生银镜反应,其中核磁共振氢谱上显示3组峰,且峰面积之比为6:1:1的是__________________(写出结构简式)。
(5)等物质的量的 分别与足量NaOH、NaHCO3 反应,消耗NaOH、NaHCO3 的物质的量之比为__________;检验
分别与足量NaOH、NaHCO3 反应,消耗NaOH、NaHCO3 的物质的量之比为__________;检验 其中一种官能团的方法是______________(写出官能团名称、对应试剂及现象)。
其中一种官能团的方法是______________(写出官能团名称、对应试剂及现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废旧锂离子二次电池(主要成分为![]() ,还含有少量石墨和金属钢売、铝箔等杂质)中回收钴和锂的工艺流程如下:回答下列问题:
,还含有少量石墨和金属钢売、铝箔等杂质)中回收钴和锂的工艺流程如下:回答下列问题:

(1)![]() 的电子式为__________。“碱浸”的目的是____________。
的电子式为__________。“碱浸”的目的是____________。
(2)“酸浸”过程中![]() 发生反应的离子方程式为______________,浸渣中含有的主要成分是_______________________。
发生反应的离子方程式为______________,浸渣中含有的主要成分是_______________________。
(3)“萃取净化”除去的杂质离子除![]() 外,还有________(填离子符号)
外,还有________(填离子符号)
(4)“苯取分离“中钴、锂的萃取率与平衡时溶液![]() 的关系如图所示,
的关系如图所示,![]() 一般选择5左右,理由是_____________________________________。
一般选择5左右,理由是_____________________________________。

(5)“沉锂“中![]() 的溶解度随温度变化的曲线如图所示:
的溶解度随温度变化的曲线如图所示:
①根据平衡原理分析![]() 在水中的溶解度随温度变化的原因______________。
在水中的溶解度随温度变化的原因______________。
②为获得高纯![]() ,提纯操作依次为热过滤、_______、烘干。
,提纯操作依次为热过滤、_______、烘干。
③若“沉锂”中![]() ,加入等体积等浓度
,加入等体积等浓度![]() 溶液,则此时沉锂率为________________。(已知
溶液,则此时沉锂率为________________。(已知![]() 的
的![]() 为
为![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列6种物质
①![]() ②
②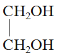 ③
③![]()
④CH3-CH=CH-CH3 ⑤![]() ⑥
⑥![]()
(1)用于制造炸药TNT的是____(填序号)。
(2)具有两性的是______(填序号)。
(3)有机物①的沸点比②______(填“高”或“低”)
(4)有机物④的名称是___________
(5)有机物④形成的高聚物结构简式为__________________
(6)检验有机物⑥中官能团的试剂是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,电流表指针发生偏转,同时A极质量减少,B极上有气泡产生,C为电解质溶液,

下列说法错误的是
A. B极为原电池的正极
B. A、B、C可能分别为Zn、Cu、稀盐酸
C. C中阳离子向A极移动
D. A极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:

我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如下图所示:

已知:
![]()
(1)①的反应类型是___________,化合物  的官能团的名称为_____________。
的官能团的名称为_____________。
(2)关于B和C,下列说法不正确的是____________(填字母序号)。
a.利用红外光谱法可以鉴别B和C b.B可以发生氧化、取代、消去反应
c.可用溴水检验C中含有碳碳三键
(3)B生成C的过程中还有另一种生成物X,分子式为C3H6O,核磁共振氢谱显示只有一组峰,X的结构简式为______________________。
(4)D生成E的化学方程式为___________________________________________________。
(5)有机物M是有机物C的同系物,其相对分子质量比C大14,写出一种满足下列条件的M的同分异构体N的结构简式是________________________。
a.除苯环外,不含其它的环状结构,不考虑立体异构;
b.能与FeC13溶液发生显色反应;
c.1mol N最多与6mol Br2(浓溴水)反应。
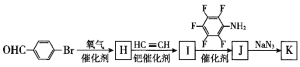
(6)为了探究连接基团对聚合反应的影响,设计了单体K( ) 其合成路线如下,写出H、J的结构简式:H____________、J_______________。
) 其合成路线如下,写出H、J的结构简式:H____________、J_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示,下列说法正确的是
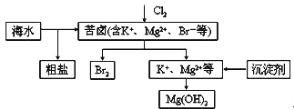
A. 得到的 Mg(0H)2 是耐火砖的主要成分
B. 粗盐可采用除杂和蒸馏等过程提纯
C. 工业生产中常选用 NaOH 作为沉淀剂
D. 富集溴一般先用空气或水蒸气吹出单质溴,再用碱液或SO2 等吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素剧期表的一部分,请根据要求填空

(1) 元素②最外层有_____个电子,在化合物中的最低负化合价为________;
(2) 元素⑤形成的离子的结构汞意图为_________;
(3) 用电子式表示元素①和⑦组成的化合物的形成过程:_______________;
(4) 元素④、⑤的最高价氧化物的水化物之间发生反应的离子方程式______________ 。
(5) 下列选项中能证明元素⑦的非金属性强于元素⑥的是________(双选)。
A.H2S的酸性弱于HCl B.S2-的还原性强于C1-
C.H2SO3的酸性强于HClO D.H2S不如HC1稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com