
| A. | $\frac{106(m-n)}{11m}$×100% | B. | $\frac{168(m-n)}{56m}$×100% | C. | $\frac{84(n-m)?}{11m}$×100% | D. | $\frac{?(n-m)?}{m}$×100% |
分析 加入盐酸发生反应:Na2CO3+2HCl═2NaCl+CO2↑+H2O,加热、蒸干、灼烧最终得到固体为NaCl,利用固体质量差、结合差量法计算碳酸钠的质量,进而计算样品中纯碱的质量分数.
解答 解:设碳酸钠的质量为x,则:
Na2CO3+2HCl═2NaCl+CO2↑+H2O 固体质量增重
106 117 11
x (m-n)
$\frac{106}{x}=\frac{11}{m-n}$
解得x=$\frac{106(m-n)}{11}$g
故该样品中纯碱的质量分数为$\frac{\frac{106(m-n)}{11}}{m}$×100%=$\frac{106(m-n)}{11m}$×100%,
故选:A.
点评 本题考查混合物有关计算,注意根据质量守恒定律理解差量法,难度不大,有利于基础知识的巩固.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 滴加甲基橙显红色的溶液中:Na+、K+、Cl-、ClO- | |
| B. | 滴入KSCN显血红色的溶液中:Na+、Mg2+、SO42-、Br- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×1012mol/L的溶液中:K+、Na+、NO3-、HCO3- | |
| D. | 由水电离的c(H+)=1.0×10-13mol/L的溶液中:NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②③④⑦ | D. | ④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
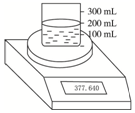 如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:| 实验操作 | 时间/s | 电子天平读数/g |
| 烧杯+水 | 370.000 | |
| 烧杯+水+样品 | 0 | 377.640 |
| 30 | 376.920 | |
| 60 | 376.400 | |
| 90 | 376.200 | |
| 120 | 376.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
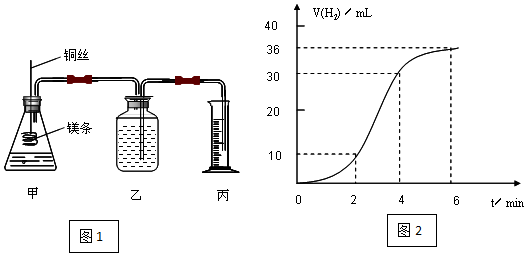
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol•L-1的FeCl3溶液中Fe3+的数目为NA | |
| B. | 32g甲烷中含有2NA个C-H键 | |
| C. | 1molNH2-含有10NA个电子 | |
| D. | 1molNa2O2与足量CO2反应.转移电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com