
| A. | 碘单质的升华过程中,只需克服分子间作用力 | |
| B. | NH4Cl属于离子化合物,该物质中不存在共价键 | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | 金刚石和足球烯(C60)均为原子晶体 |
分析 A.碘单质的升华过程中,只有状态的变化、物质不变;
B.NH4Cl含离子键及N-H共价键;
C.SiO2由原子构成;
D.足球烯(C60)由分子构成.
解答 解:A.碘单质的升华过程中,只有状态的变化、物质不变,则只需克服分子间作用力,故A正确;
B.NH4Cl含离子键及N-H共价键,为离子化合物,故B错误;
C.SiO2由原子构成,为原子晶体,而N2、CO2由分子构成,均含共价键,故C错误;
D.足球烯(C60)由分子构成,为分子晶体,而金刚石为原子晶体,故D错误;
故选A.
点评 本题考查化学键及晶体类型,为高频考点,把握物质中的化学键、物质构成、晶体类型为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


科目:高中化学 来源: 题型:实验题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
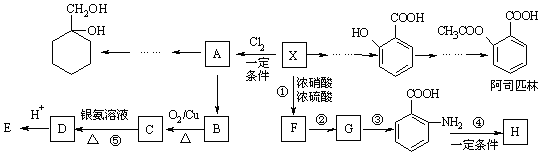
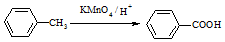
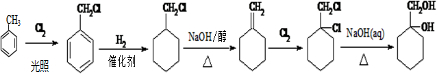
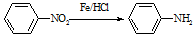 (苯胺,易被氧化)
(苯胺,易被氧化)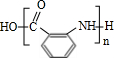 ;
;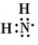 ;
;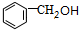 +
+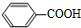 $?_{△}^{催化剂}$
$?_{△}^{催化剂}$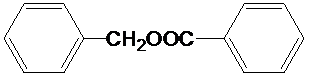 +H2O;
+H2O;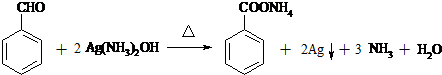 ;
;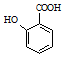 有多种同分异构体,其中符合下列条件的一共有9种,其中核磁共振氢谱有4组吸收峰的是
有多种同分异构体,其中符合下列条件的一共有9种,其中核磁共振氢谱有4组吸收峰的是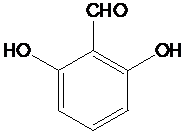 (任意写一种)
(任意写一种)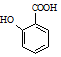 的方案.例:
的方案.例: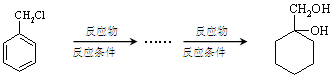
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
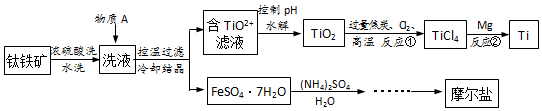
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑦⑧ | B. | ②③⑦⑧ | C. | ③④⑤⑦ | D. | ④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.Fe还原水体中NO3-的反应原理如图所示.正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.
用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.Fe还原水体中NO3-的反应原理如图所示.正极的电极反应式是NO3-+8e-+10H+=NH4++3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
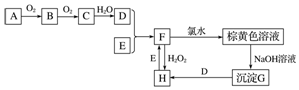
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如图所示的实验装置.实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶Ⅰ中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空.
为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如图所示的实验装置.实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶Ⅰ中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com