
【题目】有关下列图象说法错误的是( )
A.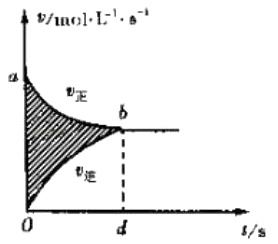
图阴影部分面积表示反应物浓度的净减少量M
B.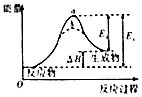
图虚线b表示反应加入催化剂后能量变化曲线
C.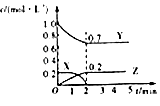
图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)2Z(g)
D.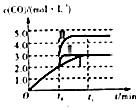
图对应于反应H2(g)+CO2(g)H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的 ![]()
【答案】C
【解析】A、图中阴影部分面积等于v正t﹣v逆t=减少反应物的物质的量浓度﹣增加反应物的物质的量浓度,所以图阴影部分面积表示反应物浓度的净减少量M,A不符合题意;
B、图象中虚线b活化能减小,所以虚线b使用了催化剂,B符合题意;
C、可逆反应是反应物和生成物共存的体系,所以达平衡状态时X的物质的量不可能为零,C不符合题意;
D、曲线I变为曲线II平衡时一氧化碳的浓度不变,但达平衡的时间缩短,说明使用催化剂,由曲线I变为曲线III瞬间一氧化碳的浓度为原来的1.5倍,所以体积变为原来的 ![]() ,则将容器的体积快速压缩为原来的
,则将容器的体积快速压缩为原来的 ![]() ,D不符合题意;
,D不符合题意;
故答案为:C.
A、总变量=|生成量-消耗量|;B、催化剂可减小反应活化能;C、可逆反应具有不彻底性;D、注意该时该物质浓度的的突变。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】海洋植物如海藻、海带中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室中从海藻中提取碘的流程如图:
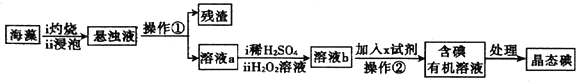
(1)溶液a中加入稀H2SO4、H2O2溶液后发生反应的离子方程式式为__________。
(2)上述流程中实验操作②的名称是__________。
(3)证明溶液b中含有单质碘的实验操作是__________。
(4)溶液b中加入的试剂X可以选择是__________。
A.酒精 B.苯 C.乙酸 D.四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前世界上60%的镁是从海水中提取的.主要步骤如下:
下列说法不正确的是( )
A. 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳
B. 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤
C. 加入试剂②反应的离子方程式为:OH﹣+H+=H2O
D. 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机物,其中A是化学实验中最常见的有机物,它易溶于水并有特殊香味;B的产量可衡量一个国家石油化工发展的水平,有关物质的转化关系如图①所示:
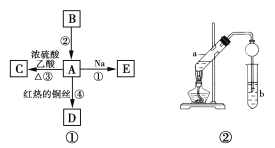
(1)写出B的结构简式__________,A中官能团的名称为__________。
(2)反应②和④的反应类型分别是__________、__________。
(3)写出下列反应的化学方程式:反应①__________,反应④__________。
(4)实验室利用反应③制取C,常用上图②装置:
①a试管中的主要化学反应的方程式为__________。
②在实验中球形干燥管除起冷凝作用外,另一个重要作用是__________。
③试管b中液体作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--物质结构与性质]世上万物,神奇可测。其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题:
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是____(填标号)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同-一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为_____,Q2+的未成对电子数是_____.
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是______, [Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有_____(填标号)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③NH3中N原子的杂化轨道类型是_____,写出一种与SO42-互为等电子体的分子的化学式:_____________。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_____________。
(4)CuO晶胞结构如图所示。

该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____ (用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。
(5)在Cu2O晶胞结构中,Cu处于正四面体空隙,O处于_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )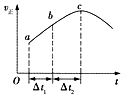
A.反应物的总能量低于生成物的总能量
B.△t1=△t2时,CO的转化率:a~b段小于bc段
C.反应在c点达到平衡状态
D.反应物浓度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型有机酰胺化合物M在工业生产中有重要的应用,其合成路线如下:

已知以下信息:
①A的相对分子质量为58,含氧的质量分数为0.552,已知核磁共振氢谱显示为一组峰,可发生银镜反应。
② ![]()
③R—COOH ![]() R—COCl
R—COCl
④
⑤
请回答下列问题:
(1)A的名称为____________,B中含有官能团名称为_____________。
(2)C→D的反应类型为__________________,生成G的“条件a”指的是___________________。
(3)E的结构简式为___________________。
(4)F+H→M的化学方程式为____________________________。
(5)芳香族化合物W有三个取代基,与C互为同分异构体,当W分别与Na、NaOH充分反应时,1mol W最多可消耗的Na、NaOH分别为2 mol、1mol。试分析W共有________种同分异构体,每一种同分异构体的核磁共振氢谱中有____________组峰。
(6)参照上述合成路线,以C2H4和HOCH2CH2OH为原料(无机试剂任选),设计制备 的合成路线___________________。
的合成路线___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中,反应A+2BC分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:
②; .
③; .
(2)实验②平衡时B的转化率为;实验③平衡时C的浓度为;
(3)该反应的△H0,其判断理由是
(4)该反应进行到4.0min时的平均反应速率:
实验②:vB=
实验③:vc= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com