
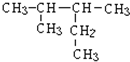 系统命名法命名的名称是
系统命名法命名的名称是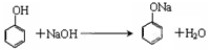 ,故答案为:
,故答案为: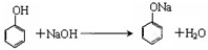 ;
; ,故答案为:
,故答案为: ;
;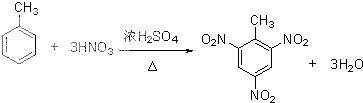 ,
,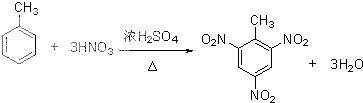 ;
;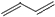 ,2-溴丙烷的键线式为
,2-溴丙烷的键线式为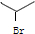 ,故答案为:
,故答案为: ;
;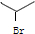 .
.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
| A、钠可以保存在煤油或四氯化碳中 |
| B、钠露置在空气中表面生成淡黄色的Na2O |
| C、钠在空气中燃烧,生成白色的Na2O2 |
| D、钠与水反应的实验可以说明钠硬度小、熔点低、密度大于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
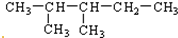
查看答案和解析>>
科目:高中化学 来源: 题型:
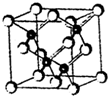 发光二极管(LED)晶片材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:
发光二极管(LED)晶片材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、lnGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如图.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
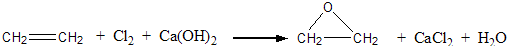
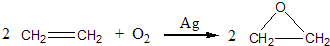
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学能在一定的条件下可以转化为电能.
化学能在一定的条件下可以转化为电能.查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol.L-1 KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B、0.1mol.L-1 NaOH溶液:Na+、Ca2+、I-、NH4+ |
| C、中性溶液:Fe3+、Al3+、NO3-、SO42- |
| D、c(H+)水电离=10-12 mol?L-1的溶液:Ba2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、小苏打与醋酸反应:HCO3-+H+═CO2↑+H2O |
| C、氯气与水反应:Cl2+H2O?2H++Cl-+ClO- |
| D、氯化铝溶液与过量氨水反应:3NH3?H2O+Al3+=Al(OH)3↓+3NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com